题目内容
15.如图是某同学设计的原电池装置,下列叙述中正确的是( )
| A. | 氧化剂和还原剂必须直接接触才能发生反应 | |
| B. | 电极Ⅱ上发生还原反应,做原电池的正极 | |
| C. | 该原电池的总反应式为2Fe3++Cu═Cu2++2Fe2+ | |
| D. | 盐桥中装有含氯化钾的琼脂,K+移向负极区 |
分析 该原电池中,铜电极易失电子发生氧化反应而作负极,铂电极上铁离子得电子发生还原反应,则铂电极是正极,盐桥的作用是平衡正负极两池的电荷.
解答 解:A.原电池中氧化剂和还原剂分别在正负极上反应,不需要直接接触就能发生反应,故A错误;
B.电极Ⅱ铜电极上铜失电子发生氧化反应,做原电池的负极,故B错误;
C.该原电池负极上铜失电子,正极上铁离子得电子,所以其电池反应式为2Fe3++Cu═Cu2++2Fe2+,故C正确;
D.盐桥的作用是平衡正负极两池的电荷,盐桥中离子的定向移动形成电流,K+移向正极区,故D错误;
故选C.
点评 本题考查原电池原理,明确正负极上得失电子是解本题关键,知道盐桥的作用,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下列实验操作或对实验相关的描述,正确的是( )
| A. | 皮肤上不慎沾到少量浓硫酸,应先用干抹布擦拭、再用大量水冲洗 | |
| B. | 检验HCl气体中是否混有Cl2,可将气体通入硝酸银溶液 | |
| C. | 验证某气体中含CO2、SO2,可依次通入品红溶液、饱和NaHCO3溶液、澄清石灰水 | |
| D. | 检验Fe2(SO4)3溶液中是否含有Fe2+,可用KMnO4酸性溶液 |
3.钚是一种具有放射性的超铀元素,几位美国科学家在1940年首次发现这一元素,它目前被应用于核武器和核反应堆.下列说法正确的是( )
| A. | ${\;}_{94}^{238}$Pu、${\;}_{94}^{239}$Pu和${\;}_{94}^{240}$Pu是钚的三种同素异形体 | |
| B. | ${\;}_{94}^{238}$Pu中有94个中子 | |
| C. | ${\;}_{94}^{239}$Pu的中子数与质子数之差为51 | |
| D. | 一个${\;}_{94}^{240}$Pu的质量为240 g |
10.下列实验操作中现象以及结论不正确的是( )
| 实验操作 | 现象 | 结论 | |
| A | 将干燥纯净的氯气通入装有湿润的红色纸条的试剂瓶中 | 纸条褪色 | 氯气有漂白性 |
| B | 将一定量的浓硫酸加入蔗糖 | 固体变黑膨胀 | 浓硫酸有吸水性和强氧化性 |
| C | 向酸性KMnO4溶液中通入SO2气体 | KMnO4溶液褪色 | SO2有还原性 |
| D | 金属钠投入CuSO4溶液 | 析出红色固体 | 钠的金属性比铜强 |
| A. | A | B. | B | C. | C | D. | D |
20.有机物的结构可用“键线式”表示.如CH3-CH═CH-CH3,可简写为 .有机物X的键线式为
.有机物X的键线式为  ,下列说法不正确的是( )
,下列说法不正确的是( )
 .有机物X的键线式为
.有机物X的键线式为  ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | X的化学式为C8H8 | |
| B. | 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为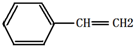 | |
| C. | X能使酸性高锰酸钾溶液褪色 | |
| D. | X与足量的H2在一定条件下反应,可生成环状的饱和烃Z,Z的一氯代物有4种 |
7.化合物A分子式为C8H8O2分子中苯环(C6H5-)上只有一个取代基,其红外光谱与核磁共振氢谱如图.关于A的下列说法中,正确的是( )


| A. | 核磁共振氢谱数据在推理A的结构式时用处不大 | |
| B. | A的结构式可表示为C6H5-COOH | |
| C. | 符合题中A分子结构特征的有机物有2种 | |
| D. | 碥定A的分子结构还需要实验数据 |
4.有四种短周期主族元素分别为X、Y、Z、W.X是地壳中含量最多的元素; Y元素的单质是空气的主要成分之一;Z原子的最外层电子数是其最内层电子数的$\frac{1}{2}$;W元素的最高正价和最低负价的代数和为0.下列说法正确的是( )
| A. | 原子半径:X<Y<W<Z | |
| B. | Z的氧化物一定只有一种 | |
| C. | 最高价氧化物对应水化物的酸性:Y<W | |
| D. | X和W两种元素形成的化合物,既能与强酸反应又能与强碱反应 |