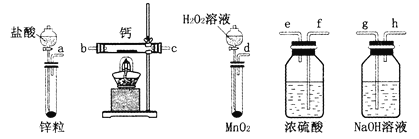
题目内容
【题目】乙烯是重要的化工原料,以乙烯为原料生产部分化工产品的流程如下(部分反应条件已略去):
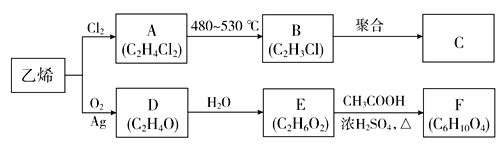
已知:E分子中含有两个羟基,且不连在同一个碳原子上。
请回答下列问题:
(1)由乙烯生成A的反应类型为________。
(2)C是一种常见的塑料,其化学名称为_________。
(3)D是环状化合物,其结构简式为__________________。
(4)写出下列反应的化学方程式:
①A→B:_____________________
②E→F:_____________________
(5)已知烯烃能发生如下反应:
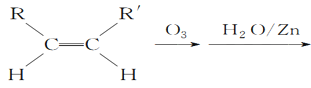 RCHO+R′CHO
RCHO+R′CHO
请写出下列反应产物的结构简式
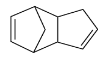
![]()
![]() ____________。
____________。
【答案】加成反应 聚氯乙烯 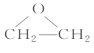 Cl—CH2—CH2—Cl
Cl—CH2—CH2—Cl![]() Cl—CH=CH2+HCl HOCH2CH2OH+2CH3COOH
Cl—CH=CH2+HCl HOCH2CH2OH+2CH3COOH![]() CH3COOCH2CH2OOCCH3+2H2O
CH3COOCH2CH2OOCCH3+2H2O 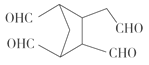
【解析】
乙烯与氯气发生加成反应生成1,2-二氯乙烷,A是Cl—CH2—CH2—Cl;A在一定条件下发生消去反应生成氯乙烯,B是Cl—CH=CH2;氯乙烯发生加聚反应生成聚氯乙烯,C是![]() ;D是分子式为C2H4O的环状化合物,D是
;D是分子式为C2H4O的环状化合物,D是 ;E分子中含有两个羟基,且不连在同一个碳原子上,E是HOCH2CH2OH;HOCH2CH2OH与乙酸发生酯化反应生成F,F是CH3COOCH2CH2OOCCH3。
;E分子中含有两个羟基,且不连在同一个碳原子上,E是HOCH2CH2OH;HOCH2CH2OH与乙酸发生酯化反应生成F,F是CH3COOCH2CH2OOCCH3。
根据以上分析,(1)乙烯生成与氯气反应生成Cl—CH2—CH2—Cl,反应类型为加成反应。
(2)氯乙烯发生加聚反应生成![]() ,
,![]() 的化学名称为聚氯乙烯。
的化学名称为聚氯乙烯。
(3)D是分子式为C2H4O的环状化合物,D是 。
。
(4)①Cl—CH2—CH2—Cl在一定条件下发生消去反应生成Cl—CH=CH2,反应方程式是Cl—CH2—CH2—Cl![]() Cl—CH=CH2+HCl;
Cl—CH=CH2+HCl;
②HOCH2CH2OH与乙酸发生酯化反应生成CH3COOCH2CH2OOCCH3的方程式是HOCH2CH2OH+2CH3COOH![]() CH3COOCH2CH2OOCCH3+2H2O;
CH3COOCH2CH2OOCCH3+2H2O;
(5)根据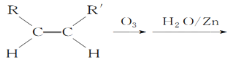 RCHO+R′CHO可知,双键碳原子被氧化为醛基, 所以
RCHO+R′CHO可知,双键碳原子被氧化为醛基, 所以![]()
![]()
![]()
 。
。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案【题目】苯乙烯(![]() )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
![]() (g)
(g)![]()
![]() (g)+H2(g)△H
(g)+H2(g)△H
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ/mol | 412 | 348 | 612 | 436 |
计算上述反应的△H=________kJ·mol-1。
(2)500℃时,在恒容密闭容器中,充入amol乙苯,反应达到平衡后容器内气体的压强为P;若再充入bmol的乙苯,重新达到平衡后容器内气体的压强为2P,则a_______b(填“>”“<”或“=”),乙苯的转化率将________(填“增大”“减小”或“不变”)。
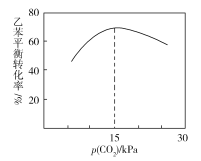
(3)工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1︰10,N2不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图
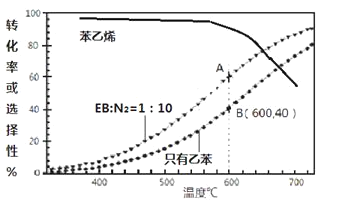
①A、B两点对应的正反应速率较大的是________。
②掺入N2能提高乙苯的平衡转化率,解释说明该事实____________。
③控制反应温度为600℃的理由是__________
【题目】(10分)含碳物质的价值型转化,有利于“减碳”和可持续性发展,有着重要的研究价值。请回答下列问题:
(1)已知CO分子中化学键为C≡O。相关的化学键键能数据如下:
化学键 | H—O | C≡O | C=O | H—H |
E/(kJ·mol1) | 463 | 1075 | 803 | 436 |
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=___________kJ·mol1。下列有利于提高CO平衡转化率的措施有_______________(填标号)。
CO2(g)+H2(g) ΔH=___________kJ·mol1。下列有利于提高CO平衡转化率的措施有_______________(填标号)。
a.增大压强 b.降低温度
c.提高原料气中H2O的比例 d.使用高效催化剂
(2)用惰性电极电解KHCO3溶液,可将空气中的CO2转化为甲酸根(HCOO),然后进一步可以制得重要有机化工原料甲酸。CO2发生反应的电极反应式为________________,若电解过程中转移1 mol电子,阳极生成气体的体积(标准状况)为_________L。
(3)乙苯催化脱氢制取苯乙烯的反应为:![]() (g)+CO2(g)
(g)+CO2(g)![]()
![]() (g)+CO(g)+H2O(g),其反应历程如下:
(g)+CO(g)+H2O(g),其反应历程如下:
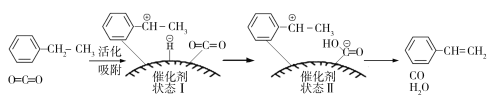
①由原料到状态Ⅰ____________能量(填“放出”或“吸收”)。
②一定温度下,向恒容密闭容器中充入2 mol乙苯和2 mol CO2,起始压强为p0,平衡时容器内气体总物质的量为5 mol,乙苯的转化率为_______,用平衡分压代替平衡浓度表示的化学平衡常数Kp=_______。[气体分压(p分)=气体总压(p总)×气体体积分数]
③乙苯平衡转化率与p(CO2)的关系如下图所示,请解释乙苯平衡转化率随着p(CO2)变化而变化的原因________________________________________________。