题目内容
将N2和H2按一定比例混合,其密度是相同状况下H2的3.6倍,取出0.5 mol该混合气体充入密闭容器里,使之发生反应并在一定条件下达到平衡,已知反应达平衡后容器内压强是相同条件下反应前的0.76倍,试求:
(1)反应前混合气体中N2和H2的体积比。
(2)达平衡时混合气体中氨的物质的量。
(3)平衡时N2的转化率。
(1)因为密度之比是相对分子质量之比
所以混合气的相对分子质量是3.6×2=7.2
因此氢气和氮气的物质的量之比是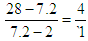
即0.5mol混合气中氢气是0.4mol,氮气是0.1mol
(2)设氮气转化率是x,则
N2 + 3H2  2NH3
2NH3
起始量(mol) 0.1 0.4 0
转化量(mol) 0.1x 0.3x 0.2x
平衡量(mol) 0.1-0.1x 0.4-0.3x 0.2x
压强之比是物质的量之比
所以有0.5×0.76=0.1-0.1x+0.4-0.3x+0.2x
解得x=0.6
因此达平衡时混合气体中氨的物质的量是0.2mol×0.6=0.12mol
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目