题目内容
【题目】(1)只用一种试剂或操作,除去下列物质中的杂质(括号内为杂质),先写出除杂时所选试剂或者操作,再写出发生的有关化学方程式。
①Fe2O3(Al2O3):___ ___
②FeCl2溶液(FeCl3):___ ___
③Na2CO3(NaHCO3):___ ___
(2)写出以下反应的化学方程式或离子方程式。
呼吸面具中CO2与过氧化钠反应化学方程式:___;
烧碱溶液与铝片的反应离子方程式:___。
【答案】NaOH Al2O3+2NaOH=2NaAlO2+H2O 铁粉 2FeCl3+Fe=3FeCl2 加热或NaOH溶液 2NaHCO3![]() CO2↑+Na2CO3+H2O(或NaHCO3+NaOH=Na2CO3+H2O) 2Na2O2+2CO2=2Na2CO3+O2↑ 2Al+2OH-+2H2O=2AlO2-+3H2↑
CO2↑+Na2CO3+H2O(或NaHCO3+NaOH=Na2CO3+H2O) 2Na2O2+2CO2=2Na2CO3+O2↑ 2Al+2OH-+2H2O=2AlO2-+3H2↑
【解析】
(1)①氧化铝与NaOH反应,而氧化铁不能;②Fe与氯化铁反应生成氯化亚铁;③碳酸氢钠与NaOH反应生成碳酸钠或碳酸氢钠加热分解能够生成碳酸钠;
(2)过氧化钠可以和二氧化碳反应生成氧气;金属铝能和强碱反应产生氢气;
据此分析解答。
(1)①氧化铝与NaOH反应,而氧化铁不能,选择的试剂为NaOH溶液,发生Al2O3+2NaOH═2NaAlO2+H2O,故答案为:NaOH;Al2O3+2NaOH═2NaAlO2+H2O;
②Fe与氯化铁反应生成氯化亚铁,选择的试剂为铁粉,发生2FeCl3+Fe═3FeCl2,故答案为:铁粉;2FeCl3+Fe═3FeCl2;
③NaHCO3固体加热分解生成碳酸钠,加热可除杂,发生2NaHCO3 ![]() CO2↑+Na2CO3+H2O,NaHCO3为溶液时加适量NaOH溶液,发生NaHCO3+NaOH═Na2CO3+H2O,故答案为:加热(或加NaOH溶液);2NaHCO3
CO2↑+Na2CO3+H2O,NaHCO3为溶液时加适量NaOH溶液,发生NaHCO3+NaOH═Na2CO3+H2O,故答案为:加热(或加NaOH溶液);2NaHCO3 ![]() CO2↑+Na2CO3+H2O(或NaHCO3+NaOH═Na2CO3+H2O);
CO2↑+Na2CO3+H2O(或NaHCO3+NaOH═Na2CO3+H2O);
(2)过氧化钠可以和二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为2Na2O2+2CO2═2Na2CO3+O2↑;金属铝能和烧碱反应生成氢气,反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:2Na2O2+2CO2═2Na2CO3+O2↑;2Al+2OH-+2H2O═2AlO2-+3H2↑。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。

有关物质性质如下表:
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有0.1mol FeCO3和200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器a的名称是________;与a相比,仪器b的优点是_____________________________。
(2)装置B中盛有的试剂是____________;实验过程中装置D的导管一直没入液面下的必要性是___________________________________________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和________________________ 。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)检验产品中是否含有Fe3+的试剂名称是_________ 。
(7)本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是_____%。
【题目】某化学反应中,设反应物的总能量为E1,生成物的总能量为E2,
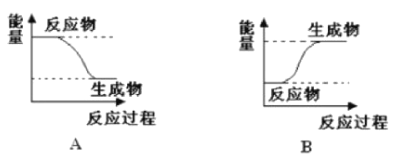
I.若E1>E2,则该反应为_____(填“放热”或“吸热”)反应。该反应可用图____(填“A”或“B”)表示。
II.若E1<E2,则该反应为______(填“放热”或“吸热”)反应。该反应可用图_____(填“A”或“B”)表示
III.下表中的数据是破坏1mol物质中的化学键所消耗的最小能量:
物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
键能(kJ/mol) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
根据上述数据回答下列问题:
(1)下列物质本身具有的能量最低的是(_____)
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中最稳定的是(_____)
A.HCl B.HBr C.HI
(3)X2+H2===2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应?_______。
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是_____(填写化学式)。



