题目内容
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.25℃时,pH=13的氨水中含有OH-的数目为0.1NA |
| B.1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA |
| C.标准状况下,2.24 LNO2与水反应生成NO3-的数目为0.1NA |
| D.4.0 g H2与足量氮气完全反应生成NH3,反应中断裂共价键的总数为2NA |
B
解析试题分析:A、不能确定溶液的体积,因此不能计算氢氧根的物质的量,A不正确;B、钠在反应中失去1个电子,因此1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA,B正确;C、标准状况下,2.24 LNO2的物质的量是0.1mol,与水反应生成硝酸和NO,所以与水反应生成NO3-的数目小于0.1NA,C不正确;D、4g氢气是2mol,与足量氮气反应生成氨气时氮氮键也断裂,因此断裂共价键的总数大于2NA,D不正确,答案选B。
考点:考查阿伏伽德罗常数的计算

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值。下列说法正确的是
| A.2.24LCO2中含有的原子数为0.3NA |
| B.1.8g NH4+离子中含有的质子数为NA |
| C.C60和石墨的混合物共1.8g,含碳原子数目为0.15NA |
| D.0.5mol/LNaOH溶液中,含Na+离子数目为0.5NA |
1919年,科学家第一次实现了人类多年的梦想——人工转变元素。这个核反应如下: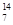 N +
N + 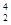 He →
He → 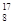 O +
O + 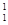 H,下列叙述正确的是 ( )
H,下列叙述正确的是 ( )
A. O2-离子结构示意图为: O2-离子结构示意图为: |
| B.氦气分子为双原子分子 |
C.一个H2 O(水分子)中含10e-,11个中子 O(水分子)中含10e-,11个中子 |
D.C O2(二氧化碳)的电子式: O2(二氧化碳)的电子式: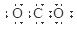 |
下列有关概念间关系的说法正确的是
| A.碱性氧化物一定是金属氧化物 |
| B.氧化剂在化学反应中一定被氧化 |
| C.酸性氧化物一定是非金属氧化物 |
| D.摩尔质量相同的物质其摩尔体积一定相同 |
下列微粒的个数比不是1∶1的是
| A.NaCl晶体中阴、阳离子 | B.NH3分子中的质子和电子 |
| C.Na2O2固体中阴、阳离子 | D. H原子中的质子和中子 H原子中的质子和中子 |
下列说法正确的是( )
| A.含有共价键的化合物一定是共价化合物 | B.气态单质分子中一定存在共价键 |
| C.含有离子键的化合物一定是离子化合物 | D.非金属元素间只能形成共价键 |
向一定量的Fe、FeO、Fe2O3的混合物中,加入200mL2 mol/L的盐酸,恰好完全反应并放出标准状况下224mL气体;向所得溶液中加入KSCN溶液后无血红色出现,则所得溶液中Fe2+的物质的量浓度为(假设反应后溶液体积仍为200mL)
| A.0.5mol·L-1 | B.l mol·L-1 | C.2mol·L-1 | D.0.1mol·L-1 |
用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.在1 L 0.1 mol/L硫化钠溶液中阴离子总数大于0.1NA |
| B.1 mol O2作氧化剂时转移电子数一定为4NA |
| C.标准状况下,22.4 L戊烷所含分子数为NA |
| D.在1 L 1.0 mol/L NaCl 溶液中含有NA个NaCl分子 |
下列有关化学用语或名称,表达错误的是
A.COCl2分子的结构式: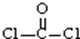 |
B.苯分子的比例模型: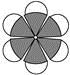 |
| C.铁在潮湿的空气中腐蚀,负极的电极反应式:Fe-2e-===Fe2+ |
D.溴化铵的电子式: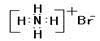 |