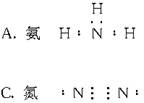题目内容
向一定量的Fe、FeO、Fe2O3的混合物中,加入200mL2 mol/L的盐酸,恰好完全反应并放出标准状况下224mL气体;向所得溶液中加入KSCN溶液后无血红色出现,则所得溶液中Fe2+的物质的量浓度为(假设反应后溶液体积仍为200mL)
| A.0.5mol·L-1 | B.l mol·L-1 | C.2mol·L-1 | D.0.1mol·L-1 |
B
解析试题分析:根据题意可知反应后的溶液为FeCl2溶液,根据Cl元素守恒可得2n(FeCl2)=" 0.2L×2" mol/L=0.4mol.所以n(FeCl2)=0.2mol.c(Fe2+)=n÷V=0.2mol÷0.2L=1mol/L。因此选项为B。
考点:考查守恒法在化学计算中的应用的知识。

练习册系列答案
相关题目
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA |
| B.常温下,10 L pH=12的Na2CO3溶液中含有的OH-离子数为0.1NA |
| C.标准状况下,22.4 LNO2和NO的混合气体中所含的氮原子总数为2NA |
| D.将含有1molFeCl3的浓溶液完全水解可得到Fe(OH)3胶粒的数目为 NA |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.25℃时,pH=13的氨水中含有OH-的数目为0.1NA |
| B.1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA |
| C.标准状况下,2.24 LNO2与水反应生成NO3-的数目为0.1NA |
| D.4.0 g H2与足量氮气完全反应生成NH3,反应中断裂共价键的总数为2NA |
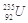 是重要的核工业原料,在自然界的含量很低,它的浓缩一直为国际社会所关注。下面列出该原子核内中子数与核外电子数之差的数据正确的是
是重要的核工业原料,在自然界的含量很低,它的浓缩一直为国际社会所关注。下面列出该原子核内中子数与核外电子数之差的数据正确的是
| A.51 | B.92 | C.143 | D.235 |
科学家发现C60后,近年又合成了许多球形分子(富勒烯),如C50、C70、C120、C540等,它们互称为
| A.同种物质 | B.同分异构体 | C.同素异形体 | D.同位素 |
下列化学用语正确的是
| A.I-131:7853I |
| B.乙烯的结构简式:CH2CH2 |
C.Cl-的结构示意图: |
D.Na2S的电子式: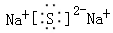 |
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
| A.78 g 苯含有碳碳双键的数目为3NA |
| B.常温常压下,22.4 L二氧化碳含有的原子总数为3NA |
| C.1 mol Fe与足量稀HNO3反应,转移3 NA个电子 |
| D.1 L 1 mol·L-1的NaClO 溶液中含有ClO-的数目为NA |