题目内容
下列说法正确的是( )
| A.含有共价键的化合物一定是共价化合物 | B.气态单质分子中一定存在共价键 |
| C.含有离子键的化合物一定是离子化合物 | D.非金属元素间只能形成共价键 |
C
解析试题分析:A.含有共价键的化合物可能是共价化合物如HCl,也可能是离子化合物如NaOH等。错误。B.气态单质分子若为单原子分子如惰性气体He气中就不存在共价键,若是双原子分子或多原子分子,就沉在共价键如H2、O3等。C.若某化合物含有离子键,就一定是离子化合物。正确。非金属元素间可能形成共价键如H2、H2O等,也可能形成离子键如NH4Cl。错误。
考点:考查元素形成的化学键与化合物的关系的知识。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
NA为阿伏加德罗常数,下列说法正确的是( )
| A.106gNa2CO3晶体中的离子总数大于3NA |
| B.0.2mol Zn与一定量浓H2SO4恰好完全反应,生成的气体分子数为0.2NA |
| C.将2mL 0.5mol·L-lNa2SiO3溶液滴入稀盐酸中制得H4SiO4胶体,所含胶粒数为0.001NA |
| D.电解精炼铜时,当阳极上质量减少6.4g时,电路上转移的电子数目为0.2NA |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.25℃时,pH=13的氨水中含有OH-的数目为0.1NA |
| B.1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA |
| C.标准状况下,2.24 LNO2与水反应生成NO3-的数目为0.1NA |
| D.4.0 g H2与足量氮气完全反应生成NH3,反应中断裂共价键的总数为2NA |
下列说法不正确的是
| A.互为同分异构体的分子结构几乎完全相同 |
| B.丙氨酸CH3-CH(NH2)-COOH存在手性异构体 |
| C.标准状况下,相同体积的NH3 、CH4、HF含有相同的电子数 |
| D.等体积的CO和N2混合后所得的混合气体的平均摩尔质量为28 g/mol |
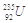 是重要的核工业原料,在自然界的含量很低,它的浓缩一直为国际社会所关注。下面列出该原子核内中子数与核外电子数之差的数据正确的是
是重要的核工业原料,在自然界的含量很低,它的浓缩一直为国际社会所关注。下面列出该原子核内中子数与核外电子数之差的数据正确的是
| A.51 | B.92 | C.143 | D.235 |
下列化学用语正确的是
| A.I-131:7853I |
| B.乙烯的结构简式:CH2CH2 |
C.Cl-的结构示意图: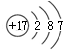 |
D.Na2S的电子式: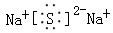 |
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.标准状况下,11.2L正丁烷所含共用电子对数为7NA |
| B.常温常压下,5.6g乙烯与丁烯的混合物中含有氢原子的数目为0.8NA |
| C.在50g质量分数为56%的乙醇水溶液中,含有氢原子总数为3NA |
D.将CO2通过Na2O2使其增重a g时,反应中转移电子数为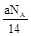 |
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
| A.78 g 苯含有碳碳双键的数目为3NA |
| B.常温常压下,22.4 L二氧化碳含有的原子总数为3NA |
| C.1 mol Fe与足量稀HNO3反应,转移3 NA个电子 |
| D.1 L 1 mol·L-1的NaClO 溶液中含有ClO-的数目为NA |
下列叙述正确的是
| A.一定温度、压强下,气体体积由其分子的大小决定 |
| B.一定温度、压强下,气体体积由其物质的量的多少决定 |
| C.气体摩尔体积是指1mol任何气体所占的体积为22.4L |
| D.不同的气体,若体积不等,则它们所含的分子数一定不等 |