��Ŀ����
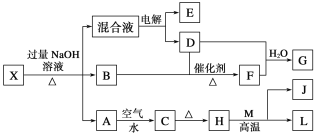
����Ŀ����һ������X����ˮ��ҺΪdz��ɫ���ɷ������µ�ת����ϵ(���ַ�Ӧ�����������)������B��D��E��F��Ϊ��ɫ���壬M��LΪ�����Ľ������ʣ�CΪ������ˮ�ĺ��ɫ���塣�ڻ��Һ�м���BaCl2��Һ�����ɲ�����ϡ����İ�ɫ������H��M��Ӧ�ɷų��������ȡ���ش��������⣺
��1��B�ĵ���ʽΪ____________��
��2�������Һʱ������ӦʽΪ_______________________��
��3��д��L���ڷ����ڳ�ʪ�����еĸ�ʴԭ����
������___________________________________��
������___________________________________��
�ܷ�Ӧ��______________________________________________________��
��4����֪a g E������D����ȫȼ�������ȶ��Ļ�����ʱ���ų�b kJ��������д��E����ȼ���ȵ��Ȼ�ѧ����ʽΪ___________________________��
���𰸡� 4OH����4e��= O2����2H2O Fe �C 2e- = Fe2+ O2 + 2H2O + 4e- = 4OH- 2Fe��O2��2H2O = 2Fe(OH)2 H2(g)��
4OH����4e��= O2����2H2O Fe �C 2e- = Fe2+ O2 + 2H2O + 4e- = 4OH- 2Fe��O2��2H2O = 2Fe(OH)2 H2(g)��![]() O2(g) = H2O(l) ����H����
O2(g) = H2O(l) ����H����![]() kJ��mol��1
kJ��mol��1
��������
M��LΪ�����Ľ������ʣ�H��M��Ӧ�ɷų��������ȣ��÷�ӦΪ���ȷ�Ӧ����MΪAl��LΪFe��CΪ������ˮ�ĺ��ɫ���壬��CΪFe(OH)3��HΪFe2O3��Ȼ����ת����ϵͼ��֪��AΪFe(OH)2��x��ˮ��ҺΪdz��ɫ�����Һ�к��������ƺ������������ƣ������м���BaCl2��Һ�����ɲ�����ϡ����İ�ɫ����������Ϊ���ᱵ��B��D��E��F��Ϊ��ɫ���壬BӦΪ��������XΪ(NH4)2Fe(SO4)2�������������Һ����EΪH2��DΪO2��������������Ӧ����FΪNO��NO��������ˮ��Ӧ����GΪ���ᣬ��Ȼ�������ʵ����ʼ���ѧ���������
���ݷ����ã�
��1��BΪ�����������ʽΪ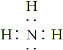 ����Ϊ��
������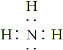 ��
��
��2����������ƺ��������ƵĻ��Һʱ�����������������ӷŵ磬�缫��ӦʽΪ40H����4e��=O2����2H2O����Ϊ
40H����4e��=O2����2H2O��
��3���ڳ�ʪ�Ļ����У�������������̼���γ�����-����-ˮ������С��ԭ��أ�������������ʴ���ɴ�֪���������������ĵ缫��ӦʽΪ��Fe �C 2e- = Fe2+�����������ĵ缫��ӦʽΪ��O2 + 2H2O + 4e- = 4OH-���ܷ�ӦʽΪ��2Fe��O2��2H2O = 2Fe(OH)2
��4��agH2������O2����ȫȼ�������ȶ��Ļ�����ʱ���ų�b kJ����������1mol Eȼ�շų�![]() ���������Ȼ�ѧ��ӦΪH2(g)��
���������Ȼ�ѧ��ӦΪH2(g)��![]() O2(g) = H2O(l) ����H����
O2(g) = H2O(l) ����H����![]() kJ��mol��1��
kJ��mol��1��
����H2(g)��![]() O2(g) = H2O(l) ����H����
O2(g) = H2O(l) ����H����![]() kJ��mol��1
kJ��mol��1

 ��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д� �����������Ż�ѧϰϵ�д�
�����������Ż�ѧϰϵ�д�����Ŀ��ԭ���������������X��Y��Z��G��Q��R��T����Ԫ�أ��˵������С��36����֪X��һ��1��2���⻯������м�����������������������ԭ�ӹ�ƽ�棻Z��L������2��δ�ɶԵ��ӣ�Qԭ�ӵ�s�ܼ���p�ܼ���������ȣ�R������������ּ���������Ӳ�Ʒ�ĺ��IJ��ϣ�T�������ڱ���ds����ԭ����ֻ��һ��δ�ɶԵ��ӡ�
(1)Yԭ�Ӻ����________�ֲ�ͬ�˶�״̬�ĵ��ӣ���̬Tԭ����________�ֲ�ͬ�ܼ��ĵ��ӡ�
(2)X��Y��Z�ĵ�һ��������С�����˳��Ϊ_______________(��Ԫ�ط��ű�ʾ)��
(3)��X��Y��Z�γɵ�����ZXY����XZ2��Ϊ�ȵ����壬��ZXY����Xԭ�ӵ��ӻ��������Ϊ_______________________��
(4)Z��R���γɻ�����ף�1 mol���к�________mol��ѧ������������ᷴӦ��������ķ��ӿռ乹�ͷֱ�Ϊ___________________��
(5)G��Q��R��������۵����±�������۵�����ԭ��Ϊ_________________��
������ | G�ķ����� | Q�ķ����� | R�ķ����� |
�۵�/K | 993 | 1539 | 183 |
(6)��T����������Һ����μ���Y���⻯���ˮ��Һ����������Ӧ�����ӷ���ʽΪ___________��
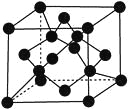
(7)X���ʵľ�����ͼ��ʾ��һ��X��������________��Xԭ�ӡ�