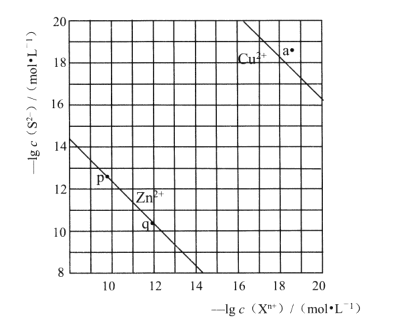
ƒøƒ⁄»›
°æƒø°ø“‘∫£√‡Õ≠£®CuO°¢Cu£©Œ™‘≠¡œ÷∆±∏¬»ªØ—«Õ≠£®CuCl£©µƒ“ª÷÷𧓒¡˜≥ûÁœ¬£∫

£®1£©Cuª˘Ã¨‘≠◊”∫ÀÕ‚µÁ◊”≈≈≤º ΩŒ™________£¨SO42 µƒø’º‰ππ–ÕŒ™__________£®”√Œƒ◊÷√Ë ˆ£©£ªCu2+ ”ÎOH£≠ ∑¥”¶ƒ‹…˙≥…[Cu(OH)4] 2£¨[Cu(OH)4] 2 ÷–÷π©π¬µÁ◊”∂‘µƒ‘≠◊” «_______£®ÃÓ‘™Àÿ∑˚∫≈£©°£
£®2£©°∞Œ¸ ’°±π˝≥ã∫
¢Ÿ2NO(g) + O2(g)![]() 2NO2(g) ¶§H =£≠112.6kJmol1÷∏flNO∆Ω∫‚◊™ªØ¬ µƒ∑Ω∑®”–______________£®–¥≥ˆ¡Ω÷÷£©°£
2NO2(g) ¶§H =£≠112.6kJmol1÷∏flNO∆Ω∫‚◊™ªØ¬ µƒ∑Ω∑®”–______________£®–¥≥ˆ¡Ω÷÷£©°£
¢⁄Œ¸ ’NO2µƒ”–πÿ∑¥”¶»Áœ¬£∫
∑¥”¶¢Ò£∫2NO2(g) + H2O(l) £Ω HNO3(aq) + HNO2(aq) ¶§H =£≠116.1kJmol1
∑¥”¶¢Ú£∫3HNO2(aq) £Ω HNO3(aq) + 2NO(g) + H2O(l) ¶§H =£≠75.9kJmol1
”√ÀÆŒ¸ ’NO2…˙≥…HNO3∫ÕNOµƒ»»ªØ—ß∑Ω≥Ã Ω «___________________°£
£®3£©°∞µÁΩ‚°±π˝≥ã∫HNO2Œ™»ıÀ·£¨Õ®π˝µÁΩ‚ πHNO3µ√“‘‘Ÿ…˙£¨—Ùº´µƒµÁº´∑¥”¶ Ω «____________°£
£®4£©°∞≥¡µÌ°±π˝≥ã∫≤˙…˙CuClµƒ¿Î◊”∑Ω≥Ã Ω «________________°£
°æ¥∞∏°ø1s22s22p63s23p63d104s1 ’˝Àƒ√ÊÖŒ O ‘ˆ¥Û—π«ø°¢Ã·∏fl—ı∆¯µƒ≈®∂» 3NO2(g)+H2O(l)=2HNO3(aq)+NO(g) ¶§H=£≠212.1kJmol1 HNO2-2e-+H2O=3H++NO3- 2Cu2++SO2+2Cl-+2H2O=2CuCl°˝+SO42-+4H+
°æΩ‚Œˆ°ø
∫£√‡Õ≠£®CuO°¢Cu£©÷–CuO”Îœ°H2SO4∑¥”¶◊™ªØŒ™¡ÚÀ·Õ≠£¨“ÚœıÀ·‘⁄À·–‘Ãıº˛œ¬æfl”–—ıªØ–‘£¨ª·Ω´Õ≠—ıªØŒ™Õ≠¿Î◊”£¨◊Ó÷’…˙≥…¡ÚÀ·Õ≠£¨SO2æfl”–ªπ‘≠–‘£¨‘ŸΩ´Õ≠¿Î◊”ªπ‘≠Œ™¬»ªØ—«Õ≠£¨NO∫œ¿Ì¿˚”√£¨æ≠π˝—ıªØ”εÁΩ‚π˝≥õ√µΩœıÀ·£¨æ›¥À∑÷ŒˆΩ‚¥°£
£®1£©Cuµƒ‘≠◊”–Ú ˝Œ™29£¨Cuª˘Ã¨‘≠◊”∫ÀÕ‚µÁ◊”≈≈≤º ΩŒ™1s22s22p63s23p63d104s1£ªSO42÷–S‘≠◊”º€≤„µÁ◊”∂‘∏ˆ ˝=4+![]() =4£¨«“≤ª∫¨π¬µÁ◊”∂‘£¨”…º€≤„µÁ◊”∂‘ª•≥‚¿Ì¬€≈–∂œ∏√Œ¢¡£Œ™’˝Àƒ√ÊÖŒ£ª[Cu(OH)4]2÷–Cu2+÷π©ø’πϵ¿£¨O‘≠◊”÷π©π¬µÁ◊”∂‘–Œ≥…≈‰Œªº¸£¨¥∞∏Œ™£∫1s22s22p63s23p63d104s1£ª’˝Àƒ√ÊÖŒ£ªO£ª
=4£¨«“≤ª∫¨π¬µÁ◊”∂‘£¨”…º€≤„µÁ◊”∂‘ª•≥‚¿Ì¬€≈–∂œ∏√Œ¢¡£Œ™’˝Àƒ√ÊÖŒ£ª[Cu(OH)4]2÷–Cu2+÷π©ø’πϵ¿£¨O‘≠◊”÷π©π¬µÁ◊”∂‘–Œ≥…≈‰Œªº¸£¨¥∞∏Œ™£∫1s22s22p63s23p63d104s1£ª’˝Àƒ√ÊÖŒ£ªO£ª
£®2£©¢Ÿ2NO(g)+O2(g)![]() 2NO2(g) ¶§H=£≠112.6kJmol1 «∆¯ÃÂê˝ºı–°µƒ∑≈»»∑¥”¶£¨Ã·∏flNO∆Ω∫‚◊™ªØ¬ £¨∆Ω∫‚”¶œÚ’˝∑¥”¶∑ΩœÚ“∆∂Ø£¨ø…“‘≤…»°µƒ¥Î ©”–£∫ΩµµÕŒ¬∂»°¢‘ˆ¥Û—π«ø°¢Ã·∏fl—ı∆¯µƒ≈®∂»µ»£ª
2NO2(g) ¶§H=£≠112.6kJmol1 «∆¯ÃÂê˝ºı–°µƒ∑≈»»∑¥”¶£¨Ã·∏flNO∆Ω∫‚◊™ªØ¬ £¨∆Ω∫‚”¶œÚ’˝∑¥”¶∑ΩœÚ“∆∂Ø£¨ø…“‘≤…»°µƒ¥Î ©”–£∫ΩµµÕŒ¬∂»°¢‘ˆ¥Û—π«ø°¢Ã·∏fl—ı∆¯µƒ≈®∂»µ»£ª
¢⁄”…∏«Àπ∂®¬…ø…÷™£∫£®∑¥”¶I3+∑¥”¶II£©![]() ø…“‘µ√µΩ”√ÀÆŒ¸ ’NO2…˙≥…HNO3∫ÕNOµƒ»»ªØ—ß∑Ω≥Ã Ω£∫3NO2(g)+H2O(l)=2HNO3(aq)+NO(g) ¶§H=£≠212.1kJmol1£ª
ø…“‘µ√µΩ”√ÀÆŒ¸ ’NO2…˙≥…HNO3∫ÕNOµƒ»»ªØ—ß∑Ω≥Ã Ω£∫3NO2(g)+H2O(l)=2HNO3(aq)+NO(g) ¶§H=£≠212.1kJmol1£ª
£®3£©µÁΩ‚π˝≥Ã÷–£¨—Ùº´…œHNO2 ß»•µÁ◊”∑¢…˙—ıªØ∑¥”¶…˙≥…HNO3£¨—Ùº´µƒµÁº´∑¥”¶ Ω «£∫HNO2-2e-+H2O=3H++NO3-£ª
£®4£©Cu2+”ÎSO2∑¢…˙—ıªØªπ‘≠∑¥”¶…˙≥…CuCl£¨¿Î◊”∑Ω≥Ã ΩŒ™£∫2Cu2++SO2+2Cl-+2H2O=2CuCl°˝+SO42-+4H+°£

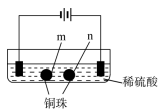
°æƒø°ø”√ ؃´µÁº´ÕÍ≥…œ¬¡–µÁΩ‚ µ—È
µ—È“ª | µ—È∂˛ | |
◊∞÷√ |
|
|
œ÷œÛ | a°¢d¥¶ ‘÷Ω±‰¿∂;b¥¶±‰∫Ï,æ÷≤øÕ …´;c¥¶Œfi√˜œ‘±‰ªØ | ¡Ω∏ˆ ؃´µÁº´∏ΩΩ¸”–∆¯≈›≤˙…˙;n¥¶”–∆¯≈›≤˙…˙°≠°≠ |
œ¬¡–∂‘ µ—Èœ÷œÛµƒΩ‚ ÕªÚÕ∆≤‚≤ª∫œ¿Ìµƒ «£® £©
A. a°¢d¥¶£∫2H2O+2e-=H2°¸+2OH- B. b¥¶£∫2Cl--2e-=Cl2°¸
C. c¥¶∑¢…˙¡À∑¥”¶£∫Fe-2e-=Fe2+ D. ∏˘æ› µ—È“ªµƒ‘≠¿Ì, µ—È∂˛÷–m¥¶ƒ‹Œˆ≥ˆÕ≠
°æƒø°ø¿˚”√œ¬¡– µ—ÈÃΩæø—«œıÀ·ƒ∆£®NaNO2£©µƒªØ—ß–‘÷ £®AgNO2 «µ≠ª∆…´ƒ—»‹”⁄ÀƵƒπÃã©
µ—È | ◊∞÷√ | ‘º¡a | œ÷œÛ |
¢Ÿ |
| ∑”Ù | Œfi…´»‹“∫±‰∫Ï |
¢⁄ | AgNO3»‹“∫ | ≤˙…˙µ≠ª∆…´≥¡µÌ | |
¢€ | µÌ∑€KI »‹“∫+œ°¡ÚÀ· | Œfi…´»‹“∫¡¢º¥±‰¿∂ | |
¢‹ | À·–‘K2Cr2O7»‹“∫ | Œfi…´»‹“∫±‰Œ™¬Ã…´ |
”……œ ˆ µ—ÈÀ˘µ√Ω·¬€≤ª’˝»∑µƒ «
A.NaNO2»‹“∫≥ ºÓ–‘£∫NO2-+H2OHNO2+OH-
B.NaNO2ø…”΃≥–©—Œ∑¢…˙∏¥∑÷Ω‚∑¥”¶£∫NO2-+Ag+=AgNO2°˝
C.NaNO2”–—ıªØ–‘£∫2I-+2H++2NO2-=I2+2NO2°¸+H2O
D.NaNO2”–ªπ‘≠–‘£∫Cr2O72-+3NO2-+8H+=3NO3-+2Cr3++4H2O