题目内容
氨在人类的生产和生活中有着广泛的应用.某化学兴趣小组利用图一装置探究氨气的有关性质.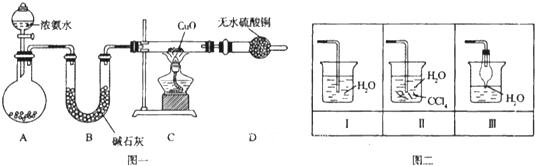
(1)装置A中烧瓶内试剂可选用
a.碱石灰 b.浓硫酸 c.生石灰 d.烧碱溶液
(2)连接好装置并检验装置的气密性后,装入药品,然后应先
Ⅰ.打开旋塞逐滴向圆底烧瓶中加入氨水Ⅱ.加热装置C
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是
(5)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成0.5L溶液,所得溶液的物质的量浓度为
分析:(1)装置A是制备氨气的发生装置,浓氨水滴入固体碱石灰或氧化钙或固体氢氧化钠都可以生成氨气;B装置是吸收水蒸气的作用;
(2)依据装置图分析,先反应生成氨气再加热装置C;
(3)依据反应现象可知,氧化铜氧化氨气为氮气,氧化铜被还原为铜;
(4)氨气极易溶于水尾气吸收需要防止倒吸;
(5)依据氨水溶液中溶质为氨气,结合物质的量浓度概念计算.
(2)依据装置图分析,先反应生成氨气再加热装置C;
(3)依据反应现象可知,氧化铜氧化氨气为氮气,氧化铜被还原为铜;
(4)氨气极易溶于水尾气吸收需要防止倒吸;
(5)依据氨水溶液中溶质为氨气,结合物质的量浓度概念计算.
解答:解:(1)装置A是制备氨气的发生装置,浓氨水滴入固体碱石灰或氧化钙或固体氢氧化钠都可以生成氨气,浓硫酸和氨气发生反应,氨气易溶入烧碱溶液,不选择浓硫酸、氢氧化钠溶液制备氨气,所以装置A中试剂为:a.碱石灰,c.生石灰;B装置中的碱石灰是吸收水蒸气,干燥氨气的作用,
故答案:ac;干燥氨气;
(2)连接好装置并检验装置的气密性后,装入药品,打开旋塞逐滴向圆底烧瓶中加入氨水发生反应生成氨气,故答案为:Ⅰ;
(3)实验中观察到C中CuO粉末变红证明生成铜,D中无水硫酸铜变蓝生成水,并收集到一种单质气体,依据氧化还原反应分析,氧化铜氧化氨气为氮气,氧化铜被还原为铜,反应的化学方程式为:3CuO+2NH3
3Cu+N2+3H2O;氮元素化合价升高为0价,做还原剂具有还原性,
故答案为:3CuO+2NH3
3Cu+N2+3H2O;还原性;
(4)氨气极易溶于水尾气吸收需要防止倒吸,图二中能用来吸收尾气的装置是Ⅱ、Ⅲ,装置Ⅰ易发生倒吸,故答案为:Ⅱ、Ⅲ;
(5)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成0.5L溶液,溶质氨气物质的量为0.1mol,所得溶液的物质的量浓度=
=0.2mol/L,
故答案为:0.2.
故答案:ac;干燥氨气;
(2)连接好装置并检验装置的气密性后,装入药品,打开旋塞逐滴向圆底烧瓶中加入氨水发生反应生成氨气,故答案为:Ⅰ;
(3)实验中观察到C中CuO粉末变红证明生成铜,D中无水硫酸铜变蓝生成水,并收集到一种单质气体,依据氧化还原反应分析,氧化铜氧化氨气为氮气,氧化铜被还原为铜,反应的化学方程式为:3CuO+2NH3
| ||
故答案为:3CuO+2NH3
| ||
(4)氨气极易溶于水尾气吸收需要防止倒吸,图二中能用来吸收尾气的装置是Ⅱ、Ⅲ,装置Ⅰ易发生倒吸,故答案为:Ⅱ、Ⅲ;
(5)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成0.5L溶液,溶质氨气物质的量为0.1mol,所得溶液的物质的量浓度=
| 0.1mol |
| 0.5L |
故答案为:0.2.
点评:本题考查了氨气实验室制备装置分析,氨气性质的分析应用,注意氨气是极易溶于水的气体,尾气吸收需要防止倒吸,题目难度中等.

练习册系列答案
相关题目
 Ⅰ.氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用.根据所学知识,据此完成下列要求.
Ⅰ.氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用.根据所学知识,据此完成下列要求.
 ________________。
________________。