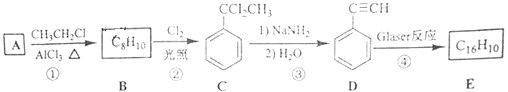
题目内容
【题目】【化学-选修3:物质结构与性质】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:
(1)写出基态As原子的核外电子排布式 .
(2)根据元素周期律,原子半径GaAs,第一电离能GaAs.(填“大于”或“小于”)
(3)AsCl3分子的立体构型为 , 其中As的杂化轨道类型为 .
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是 .
(5)GaAs的熔点为1238℃,密度为ρ gcm﹣3 , 其晶胞结构如图所示.
该晶体的类型为 , Ga与As以键键合.Ga和As的摩尔质量分别为MGa gmol﹣1和MAs gmol﹣1 , 原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA , 则GaAs晶胞中原子的体积占晶胞体积的百分率为 .
【答案】
(1)1s22s22p63s23p63d104s24p3
(2)大于;小于
(3)三角锥形;sp3
(4)GaF3的为离子晶体,GaCl3的为分子晶体,离子晶体的熔点高
(5)原子晶体;共价;![]() x100%
x100%
【解析】(1)As为ⅤA族33号元素,电子排布式为:1s22s22p63s23p63d104s24p3 , 所以答案是:1s22s22p63s23p63d104s24p3;
(2)根据元素周期变,Ga与As位于同一周期,Ga原子序数小于As,故半径Ga大于As,同周期第一电离能从左到右,逐渐增大,故第一电离能Ga小于As,所以答案是:大于;小于;
(3)AsCl3中价层电子对个数=σ键个数+孤电子对个数=3+ (5-3X1)/2=4,所以原子杂化方式是sp3 , 由于有一对孤对电子对,分子空间构型为三角锥形,所以答案是:三角锥形;sp3;(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是GaF3为离子晶体,GaCl3为分子晶体,离子晶体的熔点高,所以答案是:GaF3的为离子晶体,GaCl3的为分子晶体,离子晶体的熔点高;(5)GaAs的熔点为1238℃,熔点较高,以共价键结合形成属于原子晶体,密度为ρ gcm﹣3 , 根据均摊法计算,As: 8X![]() +6X
+6X![]() ,Ga:4×1=4,故其晶胞中原子所占的体积V1=
,Ga:4×1=4,故其晶胞中原子所占的体积V1= ![]() ,晶胞的体积V2=
,晶胞的体积V2= ![]() =
= 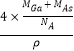 ,故GaAs晶胞中原子的体积占晶胞体积的百分率为
,故GaAs晶胞中原子的体积占晶胞体积的百分率为 ![]() ×100%将V1、V2带入计算得百分率,所以答案是:原子晶体;共价;
×100%将V1、V2带入计算得百分率,所以答案是:原子晶体;共价; ![]() ×100%.
×100%.