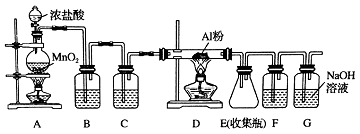
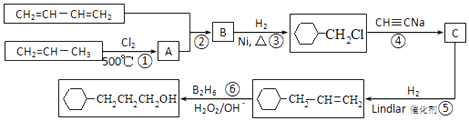
题目内容
【题目】铜及其化合物在科学研究和工业生产中具有许多用途.
(1)纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,已知高温下Cu2O比CuO稳定,
①画出基态Cu原子的价电子轨道排布图;
②从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因;
(2)CuSO4溶液常用作农药、电镀液等,向CuSO4溶液中滴加足量浓氨水,直至产生的沉淀恰好溶解,可得到深蓝色的透明溶液,再向其中加入适量乙醇,可析出深蓝色的Cu(NH3)4SO4H2O晶体.
①沉淀溶解的离子方程式为;
②Cu(NH3)4SO4H2O晶体中存在的化学键有;
a.离子键 b.极性键 c.非极性键 d.配位键
③SO42﹣的立体构型是 , 其中S原子的杂化轨道类型是;
(3)Cu晶体中原子的堆积方式如图所示(为面心立方最密堆积),则晶胞中Cu原子的配位数为 , 若Cu晶体的晶胞参数a=361.4pm,则Cu晶体的密度是(只用数字列算式) 
【答案】
(1)![]() ;Cu+的最外层电子排布为3d10 , 而Cu2+的最外层电子排布为3d9 , 因最外层电子排布达到全满时稳定,所以固态Cu2O稳定性强于CuO
;Cu+的最外层电子排布为3d10 , 而Cu2+的最外层电子排布为3d9 , 因最外层电子排布达到全满时稳定,所以固态Cu2O稳定性强于CuO
(2)Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH﹣;a、b、d;正四面体;sp3
(3)12;![]()
【解析】解:(1)①Cu是29号元素,价层电子的排布为3d104s1 , 所以价电子轨道排布图为 ![]() ,
,
所以答案是: ![]() ;
;
②轨道中电子排布达到全满、半满、全空时原子最稳定,Cu+的最外层电子排布为3d10 , 而Cu2+的最外层电子排布为3d9 , 因最外层电子排布达到全满时稳定,所以固态Cu2O稳定性强于CuO,
所以答案是:Cu+的最外层电子排布为3d10 , 而Cu2+的最外层电子排布为3d9 , 因最外层电子排布达到全满时稳定,所以固态Cu2O稳定性强于CuO;(2)①向硫酸铜中加入氨水,得到的是氢氧化铜沉淀,故溶解氢氧化铜的原理与制取银铵溶液相似,故反应的离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH﹣ ,
所以答案是:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH﹣;
②配合物中,中心离子与配体之间有配位键,内界和外界之间是离子键,氨分子和水分子中都有极性共价键,所以Cu(NH3)4SO4H2O晶体中存在的化学键有离子键、极性键、配位键,故选a、b、d;
③SO42﹣的中心原子硫原子的价层电子对数为 ![]() =4,没有孤电子对,所以SO42﹣的空间构型为正四面体,根据价层电子对互斥理论可知,S原子的杂化方式为sp3 ,
=4,没有孤电子对,所以SO42﹣的空间构型为正四面体,根据价层电子对互斥理论可知,S原子的杂化方式为sp3 ,
所以答案是:正四面体;sp3;(3)根据Cu晶体的晶胞结构示意图可知,以顶点铜原子为例,距离最近的铜原子位于晶胞的面心上,这样的原子有12个,所以晶胞中Cu原子的配位数为12,Cu晶体的晶胞中含有铜原子数为 ![]() =4,根据
=4,根据 ![]() 可知晶胞的密度为
可知晶胞的密度为 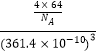 g/cm3=
g/cm3= ![]() g/cm3 ,
g/cm3 ,
所以答案是:12; ![]() .
.

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案