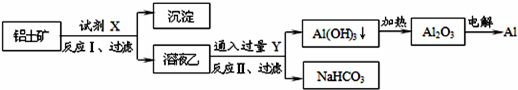
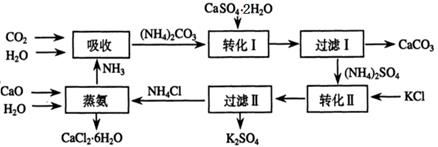
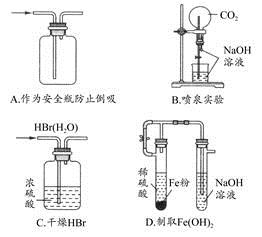
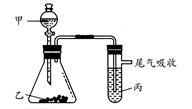
题目内容
下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 取等物质的量的两种金属单质X、Y,分别与足量的盐酸反应 | X产生氢气的体积比Y多 | 金属性:X>Y |
| B | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HA酸性比HB强 |
| C | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 有白色沉淀生成,苯层呈紫色 | 白色沉淀可能为CuI |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
C
试题分析:A.比较金属活动性的强弱不能看与酸发生反应时置换出氢气的多少,而一个看置换氢的难易。错误。B.当等体积等pH的两种不同的酸一足量的金属发生置换反应时,哪种产生的氢气越多,说明那个溶液中的酸的物质的量也越多。而产生的c(H+)却相同。因此放出的氢气多且反应速率快的酸的电离程度越小,酸性越弱。错误。C.在CuSO4溶液中加入KI溶液,再加入苯,苯层呈紫色,说明发生了氧化还原反应,产生了I2,Cu2+被还原为Cu+,振荡有白色沉淀生成,白色沉淀可能为CuI。正确。D.Na2O2粉末久置可能与空气中的H2O和CO2发生反应得到Na2CO3,若向其中滴加过量的盐酸,会发生反应:Na2CO3+ 2HCl=2NaCl+H2O+ CO2↑而产生CO2气体。因此不能根据产生无色气体就判断Na2O2没有变质。错误。4与Na2O2的化学性质及溶液的酸性、金属活动性强弱的比较的知识。

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目