题目内容
【题目】(1)K2Cr2O7的水溶液中存在如下平衡:Cr2O72-(aq)+ H2O(l)![]() 2CrO42-(aq)+ 2H+(aq),平衡常数表达式__________已知:在水溶液中K2Cr2O7为橙红色,K2CrO4为黄色)往上述溶液中加入氢氧化钠溶液呈___色;向已加入氢氧化钠的溶液中,再加入过量硫酸溶液呈___________色;此实验现象,符合勒夏特列原理:如果改变维持化学平衡的条件(浓度、压力和温度),平衡就会向着_________这种改变的方向移动,
2CrO42-(aq)+ 2H+(aq),平衡常数表达式__________已知:在水溶液中K2Cr2O7为橙红色,K2CrO4为黄色)往上述溶液中加入氢氧化钠溶液呈___色;向已加入氢氧化钠的溶液中,再加入过量硫酸溶液呈___________色;此实验现象,符合勒夏特列原理:如果改变维持化学平衡的条件(浓度、压力和温度),平衡就会向着_________这种改变的方向移动,
(2)在KMnO4与H2C2O4反应中,可通过测定_________________来测定该反应的速率;写出酸性条件下KMnO4与H2C2O4(弱酸)反应,产生二氧化碳气体、水和Mn2+的离子反应方程式:__________________;此反应开始反应缓慢,随后反应迅速加快,其原因是______(填字母)
A. KMnO4溶液中的H+起催化作用
B. 生成的CO2逸出,使生成物浓度降低
C.反应中,生成的Mn2+起催化作用
D. 在酸性条件下KMnO4的氧化性增强
(3)为探讨化学反应速率的影响因素,设计的实验方案如下表。(已知 I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)
实验 序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
①该实验进行的目的是_____________淀粉溶液的作用是____________。
②表中Vx=_______mL,比较t1、t2、t3大小____________,试推测该实验结论: ____________
【答案】 K= 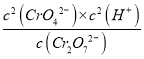 黄 橙 减弱 溶液紫色褪色时间 5H2C2O4+2MnO4-+6H+=10CO2↑+5Mn2++8H2O C 其他条件不变,探究浓度对化学反应速率的影响 显色剂,检验I2的存在 4.0 t1<t2<t3 其它条件不变,增大浓度加快反应速率
黄 橙 减弱 溶液紫色褪色时间 5H2C2O4+2MnO4-+6H+=10CO2↑+5Mn2++8H2O C 其他条件不变,探究浓度对化学反应速率的影响 显色剂,检验I2的存在 4.0 t1<t2<t3 其它条件不变,增大浓度加快反应速率
【解析】(1)平衡常数等于生成物浓度幂之积比上反应物浓度幂之积,所以K=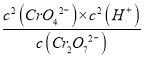 ;反应Cr2O72-+H2O2CrO42-+2H+,加入氢氧化钠溶液,氢氧根离子中和氢离子,平衡向着正向移动,溶液呈黄色;加入过量硫酸溶液,溶液中氢离子浓度增大,平衡向着逆向移动,溶液呈橙红色;如果改变维持化学平衡的条件(浓度、压力和温度),平衡就会向着减弱这种改变的方向移动;
;反应Cr2O72-+H2O2CrO42-+2H+,加入氢氧化钠溶液,氢氧根离子中和氢离子,平衡向着正向移动,溶液呈黄色;加入过量硫酸溶液,溶液中氢离子浓度增大,平衡向着逆向移动,溶液呈橙红色;如果改变维持化学平衡的条件(浓度、压力和温度),平衡就会向着减弱这种改变的方向移动;
(2)在KMnO4与H2C2O4反应中,根据高锰酸钾溶液褪色的时间比较反应速率;KMnO4与H2C2O4(弱酸)反应,产生二氧化碳气体、水和Mn2+,根据化合价升降相等配平,反应的化学方程式为:2MnO4-+5H2C2O4 +6H+=2Mn2++8H2O+10CO2↑;A.KMnO4溶液中的H+起催化作用,由于反应开始时溶液中氢离子就存在,反应速率比较慢,说明氢离子不是反应速率迅速加快的原因,故A错误;B.生成的CO2逸出,使生成物浓度降低,生成二氧化碳逸出,生成物浓度减小,反应速率应该减小,故B错误;C. 反应中,生成的Mn2+起催化作用,由于反应刚开始时,溶液中锰离子浓度较小,随着反应的进行,溶液中锰离子浓度增大,锰离子对反应具有催化作用,故C正确;D.若是因为酸性条件下KMnO4的氧化性增强,则反应开始时反应速率就应该很快,故D错误;故答案为C;
(3)①为了探究反应物浓度对化学反应速率的影响,则除了Na2S2O3溶液的浓度不同外;淀粉作为显色剂,检验碘的存在,可根据颜色的变化判断反应的快慢;
②应保持其他影响因素一致,即应使溶液体积均为16mL,故Vx=4.0mL;由于在三个实验中Na2S2O3溶液的体积①>②>③,而混合后溶液体积相同,故混合后Na2S2O3浓度①>②>③,可知化学反应速率①>②>③,反应所需时间T的大小t1<t2<t3,得出的结论是其他条件不变,反应物浓度越大,化学反应速率越大。
