题目内容
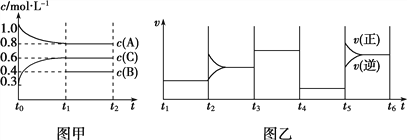
【题目】若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,一定浓度的某酸(H2A)水溶液中pC(H2A)、pC(HAˉ)、pC(A2-)随着溶液pH的变化曲线如图所示。下列说法一定正确的是

A. pH=4时,c(HAˉ)<c(A2-)
B. c(H2A)+c(HAˉ)+c(A2-)是定值
C. 该酸的电离常数Ka1=10-1.3
D. 常温下,NaHA的水溶液呈碱性
【答案】C
【解析】随PH增大,C(H2A)减小、C(HAˉ)先增后减、C(A2-)增大;根据图示,曲线Ⅰ表示c(HAˉ)、曲线Ⅱ表示C(H2A)、曲线Ⅲ表示c(A2-);根据图示,pH=4时,c(HAˉ)>c(A2-),故A错误;调节溶液PH的方法不确定,所以c(H2A)+c(HAˉ)+c(A2-)不一定是定值,故B错误;根据图示C(H2A)= C(HAˉ)时,PH=1.3,所以Ka1=![]() = 10-1.3,故C正确;根据图示c(A2-)= C(HAˉ)时,PH=4.3,Ka2=
= 10-1.3,故C正确;根据图示c(A2-)= C(HAˉ)时,PH=4.3,Ka2=![]() ,HAˉ的水解常数=
,HAˉ的水解常数=![]() ,电离大于水解,所以NaHA的水溶液呈酸性,故D错误。
,电离大于水解,所以NaHA的水溶液呈酸性,故D错误。
电解:酸式弱酸盐NaHA溶液酸碱性的判断方法:若HAˉ的电离平衡常数大于HAˉ的水解平衡常数,溶液呈酸性;若HAˉ的电离平衡常数小于HAˉ的水解平衡常数,溶液呈碱性。

【题目】Ⅰ、元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的Cr2O72还原成Cr3+,该反应的离子方程式为______________。
Ⅱ、以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________
(2)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
III、氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下:

在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2,回答下列问题:
反应②中发生反应的离子方程式为___________,___________。