题目内容
汽车内燃机工作时产生的电火花和高温会引起反应:N2(g)+O2(g)═2NO(g),导致汽车尾气中的NO和NO2对大气造成污染.
(1)在不同温度(T1,T2)下,一定量的NO分解产生N2和O2的过程中N2的体积分数随时间t变化如图1所示.根据图象判断反应N2(g)+O2(g)═2NO(g)为 反应(填“吸热”或“放热”),随着温度的升高,该反应的平衡常数K (填“增大”“减小”或“不变”,平衡向 移动(填“向左”“向右”或“不”).
(2)某温度时,向容积为1L的密闭容器中充入5mol N2与2.5mol O2,发生N2(g)+O2(g)═2NO(g)反应,2min后达到平衡状态,NO的物质的量为1mol,则2min内氧气的平均反应速率为 ,该温度下,反应的平衡常数K= .该温度下,若开始时向上述容器中加入的N2与O2均为1mol,则N2的平衡浓度为 mol/L.
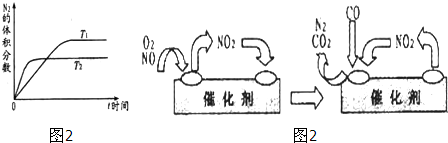
(3)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置.净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如图2所示.写出上述变化中的总化学反应方程式: .
(4)用CH4催化还原NO2的方法也可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
写出CH4还原NO2至N2的热化学方程式 .

(1)在不同温度(T1,T2)下,一定量的NO分解产生N2和O2的过程中N2的体积分数随时间t变化如图1所示.根据图象判断反应N2(g)+O2(g)═2NO(g)为
(2)某温度时,向容积为1L的密闭容器中充入5mol N2与2.5mol O2,发生N2(g)+O2(g)═2NO(g)反应,2min后达到平衡状态,NO的物质的量为1mol,则2min内氧气的平均反应速率为
(3)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置.净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如图2所示.写出上述变化中的总化学反应方程式:
(4)用CH4催化还原NO2的方法也可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
写出CH4还原NO2至N2的热化学方程式
考点:化学平衡的影响因素,热化学方程式,反应速率的定量表示方法
专题:化学反应中的能量变化,化学平衡专题,化学反应速率专题
分析:(1)根据图2判断的T1、T2大小,再根据平衡时氮气的体积分数判断温度对平衡的影响;
(2)利用v=
进行计算;
平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比;
令N2转化的物质的量为xmol,利用三段式求出反应混合物各组分物质的量的变化量、平衡时反应混合物各组分物质的量,再求出平衡浓度;
(3)判断出反应物、产物,配平写出方程式;
(4)结合2个反应,利用盖斯定律进行计算.
(2)利用v=
| △c |
| t |
平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比;
令N2转化的物质的量为xmol,利用三段式求出反应混合物各组分物质的量的变化量、平衡时反应混合物各组分物质的量,再求出平衡浓度;
(3)判断出反应物、产物,配平写出方程式;
(4)结合2个反应,利用盖斯定律进行计算.
解答:
解:(1)根据图2判断,T2曲线先到达平衡,反应速率大,温度较高,而温度升高,氮气的体积分数减小,说明升高温度平衡向正反应移动,升高温度向吸热方向进行,故正反应为吸热反应;
升高温度平衡向正反应移动,故平衡常数K值增大,
故答案为:吸热,增大,向右;
(2)利用三段式求出反应混合物各组分物质的量的变化量、平衡时反应混合物各组分物质的量.
N2(g)+O2(g)?2NO(g),
起始(mol):5 2.5 0
反应(mol):0.5 0.5 1
平衡(mol):4.5 2 1
故v(O2)=
=0.25mol/(L?min);
所以平衡常数k=
=
=
;
令N2转化的物质的量为xmol,则
N2(g)+O2(g)?2NO(g),
起始(mol):1 1 0
反应(mol):x x 2x
平衡(mol):1-x 1-x 2x
所以
=
,解得x=
,
故N2的平衡浓度为1-
=
mol/L,
故答案为:0.25mol/(L?min),
,
;
(3)NO2为中间产物,反应物为NO、O2、CO,产物为CO2、N2,反应方程式为:2NO+O2+4CO
CO2+N2,
故答案为:2NO+O2+4CO
CO2+N2;
(4)CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol①
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol②,
由
(①+②)得到:反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),△H=
×[(-574)+(-1160)]=-867kJ?mol-1,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol.
升高温度平衡向正反应移动,故平衡常数K值增大,
故答案为:吸热,增大,向右;
(2)利用三段式求出反应混合物各组分物质的量的变化量、平衡时反应混合物各组分物质的量.
N2(g)+O2(g)?2NO(g),
起始(mol):5 2.5 0
反应(mol):0.5 0.5 1
平衡(mol):4.5 2 1
故v(O2)=
| ||
| 2min |
所以平衡常数k=
| [c(NO)]2 |
| c(N2)?c(O2) |
| 1×1 |
| 4.5×2 |
| 1 |
| 9 |
令N2转化的物质的量为xmol,则
N2(g)+O2(g)?2NO(g),
起始(mol):1 1 0
反应(mol):x x 2x
平衡(mol):1-x 1-x 2x
所以
(
| ||||
|
| 1 |
| 9 |
| 1 |
| 7 |
故N2的平衡浓度为1-
| 1 |
| 7 |
| 6 |
| 7 |
故答案为:0.25mol/(L?min),
| 1 |
| 9 |
| 6 |
| 7 |
(3)NO2为中间产物,反应物为NO、O2、CO,产物为CO2、N2,反应方程式为:2NO+O2+4CO
| ||
故答案为:2NO+O2+4CO
| ||
(4)CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol①
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol②,
由
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol.
点评:本题考查化学平衡计算、平衡移动、盖斯定律,难度中等.要注意利用三段式解题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
已知某反应aA(g)+bB(g)═cC(g)的各物质浓度数据如下:
据此可推算出上述方程式中各物质的化学计量数之比是( )
| A | B | C | |
| 起始浓度(mol/L) | 3.0 | 1.0 | 0 |
| 2s末浓度(mol/L) | 1.8 | 0.6 | 0.8 |
| A、9:3:4 |
| B、3:1:2 |
| C、2:1:3 |
| D、3:2:1 |
若ABn分子的中心原子上没有孤对电子,应用价层电子对互斥模型理论,判断下列说法正确的是( )
| A、n=3时,则分子的立体构型为V形 |
| B、n=2时,则分子的立体构型平面三角形 |
| C、n=4时,则分子的立体构型为正四面体形 |
| D、n=4时,则分子的立体构型为三角锥形 |
A、B的混合气体在密闭容器中发生如下反应:xA(g)+yB(g)?zC(g)△H<0.达到化学平衡后测得A的浓度为0.20mol?L-1;保持温度不变,将密闭容器的容积缩小至原来的一半,再次达到平衡时,测得A的浓度为0.35mol?L-1.则下列有关判断正确的是( )
| A、平衡向逆反应方向移动了 |
| B、x+y>z |
| C、B的转化率下降 |
| D、C的体积分数减小 |