题目内容
【题目】N,P,As等元素的化合物在生产和研究中有许多重要用途。请回答下列问题:
(1)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子,该分子的空间构型与P4类似,其中氮原子的轨道杂化方式为_______,N—N键的键角为____。
(2)基态砷原子的价电子排布图为_______,砷与同周期相邻元素的第一电离能由大到小的顺序为______。
(3)配位原子对孤对电子的吸引力越弱,配体越容易与过渡金属形成配合物。![]() 与
与![]() 的结构相似,和过渡金属更容易形成配合物的是__________
的结构相似,和过渡金属更容易形成配合物的是__________![]() 填PH4”或“
填PH4”或“![]() ”
”![]() 。
。
(4)SCl3+和![]() 是等电子体,
是等电子体,![]() 的空间构型是_________。
的空间构型是_________。![]() 键键长____
键键长____![]() 键键长
键键长![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ,原因是____________。
,原因是____________。
【答案】sp3 60° ![]() As>Se>Ge PH3 三角锥形 < S 原子半径小于P原子半径,故 S-Cl 键要比 P-Cl 键短
As>Se>Ge PH3 三角锥形 < S 原子半径小于P原子半径,故 S-Cl 键要比 P-Cl 键短
【解析】
(1)N4分子的空间构型与P4类似,4个N原子形成正四面体构型,每个N原子形成3个N-N键,还含有1对孤对电子;
(2)As元素处于第四周期VA族,价电子排布式为4s24p3,结合泡利原理、洪特规则画出价电子排布图;As原子4p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的;
(3)元素的电负性越小,对孤电子对吸引越弱,越容易形成配位键;
(4)PCl3中P原子形成3个P-Cl键,含有1对孤对电子,其空间结构三角锥形,而等电子体的结构相似;原子半径越小,原子之间形成的共价键越短。
(1)N4分子的空间构型与P4类似,4个N原子形成正四面体构型,每个N原子形成3个N-N键,还含有1对孤对电子,杂化轨道数目为4,故N原子采取sp3杂化,每个面均为正三角形,故N-N键的键角为60°;
(2)As元素处于第四周期VA族,价电子排布式为4s24p3,价电子排布图为:![]() ,As原子4p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能:As>Se>Ge;
,As原子4p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能:As>Se>Ge;
(3)P元素的电负性比N元素的小,P原子对孤电子对吸引更弱,容易给出孤对电子形成配位键;
(4)PCl3中P原子形成3个P-Cl键,含有1对孤对电子,其空间结构三角锥形,而等电子体的结构相似,SCl3+的空间构型是三角锥形, S 原子半径小于P原子半径,故 S-Cl 键要比 P-Cl 键短。

【题目】(1)Al2(SO4)3溶液加热蒸干并灼烧最终得到物质是________________(填化学式),将NaHCO3与Al2(SO4)3两者溶液混合后可做泡沫灭火剂,其原理是_____________________(用离子方程式表示)
(2)实验室溶液中常用NaOH来进行洗气和提纯。当100mL 1mol·L-1的NaOH溶液吸收标准状况下2.24LSO2时,所得溶液中各离子浓度由大到小的顺序为____________________________
(3)25℃时,几种离子开始沉淀时的pH如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加NaOH溶液时,_____先沉淀(填离子符号),要使0.3mol·L-1硫酸铜溶液中Cu2+沉淀较为完全(当Cu2+浓度降至10-5 mol·L-1时),则应向溶液里加入氢氧化钠溶液使溶液pH为____(KspCu(OH)2=1×10-20)
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
A | B | C | D | |
图示 |
|
|
|
|
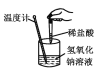
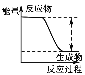
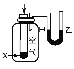
相关 信息 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A.AB.BC.CD.D