题目内容
【题目】元素X位于第4周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有1对成对电子。X与Y形成的化合物的晶胞结构如图所示,下列关于该晶体的说法正确的是( )
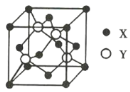
A.该晶体属于原子晶体
B.X2+的配位数为8,Y2-的配位数为4
C.与每个Y2-距离最近且相等的Y2-共有12个
D.该晶体的熔点比氧化锌高
【答案】C
【解析】
元素X位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为2,所以该原子有30个电子,为Zn元素;元素Y基态原子的p轨道上有1对成对电子,说明3p轨道上有4个电子,核外电子排布为1s22s22p63s23p4,则Y是S元素,则化学式为ZnS,据此解题。
A.ZnS含有Zn2+和S2-,属离子晶体,故A错误;
B.因为化学式为ZnS,所以Y2-离子的配位数为4,则X2+离子的配位数也为4,故B错误;
C.由晶胞可知,与每个X2+距离最近的X2+在其面心,则共有![]() =12个,故C正确,
=12个,故C正确,
D.离子晶体ZnO的晶格能比ZnS大,则ZnO的熔点比ZnS高,故D错误;
故答案为C。

练习册系列答案
相关题目