题目内容
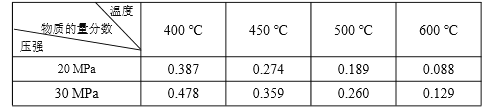
【题目】已知:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·molˉ1。起始反应物为 N2 和 H2物质的量之比为 1︰3,且总物质的量不变,在不同压强和温度下,反应达到平衡时 体系中 NH3 的物质的量分数如下表:
2NH3(g) ΔH=-92.4 kJ·molˉ1。起始反应物为 N2 和 H2物质的量之比为 1︰3,且总物质的量不变,在不同压强和温度下,反应达到平衡时 体系中 NH3 的物质的量分数如下表:
下列说法正确的是
A. 体系中 NH3 的物质的量分数越大,则正反应速率越大
B. 反应达到平衡时,N2 和 H2 的转化率之比均为 1
C. 反应达到平衡时,放出的热量均为 92.4 kJ
D. 600 ℃,30 MPa 下反应达到平衡时,生成 NH3 的物质的量最多
【答案】B
【解析】相同压强下,体系温度越低, NH3 的物质的量分数越大,正反应速率越小,故A错误;设N2 和 H2物质的量分别为 1mol、3mol,根据方程式 N2(g)+3H2(g) ![]() 2NH3(g),反应中消耗氮气xmol,则消耗氢气3xmol,反应达到平衡时,N2 和 H2 的转化率都是x,故B正确;只有生成2mol氨气才放出92.4 kJ的热量,故C错误;根据表格数据,400 ℃、30 MPa 下反应达到平衡时,生成 NH3 的物质的量最多,故D错误。
2NH3(g),反应中消耗氮气xmol,则消耗氢气3xmol,反应达到平衡时,N2 和 H2 的转化率都是x,故B正确;只有生成2mol氨气才放出92.4 kJ的热量,故C错误;根据表格数据,400 ℃、30 MPa 下反应达到平衡时,生成 NH3 的物质的量最多,故D错误。

练习册系列答案
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目