��Ŀ����
����Ŀ���������ֳƻ����������������ԭ�ϣ�����Ҫ�ɷ�ΪFeS2.850�桫900��ʱ�������������������գ����ܷ������з�Ӧ����������е�N2��O2�����Ϊ4��1����3FeS2+8O2��Fe3O4+6SO2 ��4FeS2+11O2��2Fe2O3+8SO2
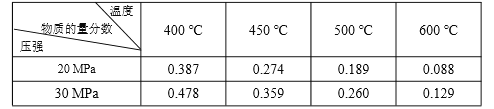
��1������35%����������Ʒ�����ʲ�������FeS2�ĺ���Ϊ ��
��2��ij���᳧ÿ���ú�FeS260%��������500t�������ᣬ����ڷ���¯����ʧ5%����SO2��ת����Ϊ90%��ÿ��������98%��������
��3�����������չ����п���������ͬʱ��������Ӧ������¯����SO2����Ҳ��ͬ����FeS2 72%���������ڿ��������ղ�����Ӧ����ȫ��Ӧ����ʽ����¯���е�SO2������������Ϊ���٣�
��4��Ϊȷ��SO2ת��ΪSO3��ת���ʣ�ij���᳧ʹ�ø��������������мӴ���������������¯����SO2��O2����������ֱ�ﵽ11%��9%��FeS2��ȫת��ΪFe2O3 �� ��ʽ���㸻�������е������������Ϊ���٣�
���𰸡�
��1��65.6%
��2��427.5t
��3���⣺��FeS2Ϊ1mol����3FeS2+8O2��Fe3O4+6SO2 ��֪����ȫ������Ҫ��n��O2��=1mol�� ![]() ������n��SO2��=2 mol����Ҫ�������ʵ���n��������=
������n��SO2��=2 mol����Ҫ�������ʵ���n��������= ![]() mol��0.2=
mol��0.2= ![]() mol����Ӧ¯�����ʵ���Ϊ2mol+
mol����Ӧ¯�����ʵ���Ϊ2mol+ ![]() mol��
mol�� ![]() =
= ![]() mol����¯����SO2������������SO2%=
mol����¯����SO2������������SO2%= ![]() ��100%=15.8%��
��100%=15.8%��
������¯����SO2���������Ϊ15.8%��
��4���⣺��¯��Ϊ100mol����SO2Ϊ11mol��O2Ϊ9mol������Ϊ100mol��11mol��9mol=80mol������4FeS2+11O2=2Fe2O3+8SO2��֪����������Ϊ11mol�� ![]() ���ʸ��������е��������ʵ���Ϊ11mol��
���ʸ��������е��������ʵ���Ϊ11mol�� ![]() +9mol=
+9mol= ![]() �����������е��������������Ϊ��
�����������е��������������Ϊ�� 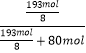 ��100%=23.2%��
��100%=23.2%��
�𣺸��������е������������Ϊ23.2%��
���������⣺��1������������Ԫ�غ���=FeS2�ĺ�����FeS2��SԪ��������������w��FeS2���� ![]() =35%�����w��FeS2��=65.6%���ʴ�Ϊ��65.6%����2����ɵ�98%��Ũ���������Ϊx���������غ�ã� 2H2SO4��FeS2
=35%�����w��FeS2��=65.6%���ʴ�Ϊ��65.6%����2����ɵ�98%��Ũ���������Ϊx���������غ�ã� 2H2SO4��FeS2
2��98t 120t
98%x 500t��60%����1��5%����90%![]()
��֮�ã�x=427.5t��
�ʴ�Ϊ��427.5t��
��1��FeS2������������FeS2��SԪ����������=��������Ʒ��SԪ��������������2������Ԫ���غ㣬�ɵù�ϵʽ��2H2SO4��FeS2 �� ��ÿһ���������ʡ���ʧ�ʶ�ת��ΪFeS2�������ʣ��ٽ�Ϲ�ϵʽ���㣻��3����FeS2Ϊ1 mol��������ȫ������Ҫ��n��O2�������ɵ�n��SO2������Ͽ���������������������������ʵ���������¯�������ʵ�������������SO2�����������4����¯��Ϊ100mol����SO2Ϊ11mol��O2Ϊ9mol������Ϊ100mol��11mol��9mol=80mol������4FeS2+11O2=2Fe2O3+8SO2���������������ʵ����������Ǽ��㸻�������е��������������

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�