题目内容
已知A、B、C、D和E都是元素周期表中前20号的元素,它们的原子序数依次增大。A原子的价电子层的p轨道中只有1个电子;B、C、D元素的基态原子具有相同的能层数,B、D元素的原子的p能级上都有1个未成对电子,D原子得一个电子填入3p轨道后,3p轨道已充满,C原子的p轨道中有3个未成对电子;E是同周期第一电离能最小的元素。
回答下列问题:
(1)写出下列元素的符号:A _____、 B_____、C______;
(2)上述五种元素中最高价氧化物对应水化物酸性最强的是__________,(填写化学式)碱性最强的是_________;(填写电子式)
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是_____,电负性最大的元素是__________;
(4)在AD3分子中A元素原子的原子轨道发生的是 杂化,分子空间构型为 ;
(5)将B 的单质投入E的最高价氧化物对应水化物中,发生反应生成物中有此离子[B(OH)4]–离子方程式是___________________________________。
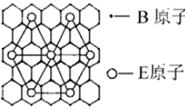
(6)石墨具有平面层状结构,同一层中的原子构成许许多多的正六边形,它与熔融的E单质相互作用,形成某种青铜色的物质(其中的元素E用“●”表示),原子分布如图所示,该物质的化学式为 。
回答下列问题:
(1)写出下列元素的符号:A _____、 B_____、C______;
(2)上述五种元素中最高价氧化物对应水化物酸性最强的是__________,(填写化学式)碱性最强的是_________;(填写电子式)
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是_____,电负性最大的元素是__________;
(4)在AD3分子中A元素原子的原子轨道发生的是 杂化,分子空间构型为 ;
(5)将B 的单质投入E的最高价氧化物对应水化物中,发生反应生成物中有此离子[B(OH)4]–离子方程式是___________________________________。
(6)石墨具有平面层状结构,同一层中的原子构成许许多多的正六边形,它与熔融的E单质相互作用,形成某种青铜色的物质(其中的元素E用“●”表示),原子分布如图所示,该物质的化学式为 。

(1)B、Al、P (各1分) (2)HClO4 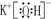 (各1分)
(各1分)
(3) Cl Cl (各1分) (4)sp2 平面三角形 (各1分)
(5) 2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ (2分)
(6)KC8 (2分)
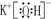 (各1分)
(各1分) (3) Cl Cl (各1分) (4)sp2 平面三角形 (各1分)
(5) 2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ (2分)
(6)KC8 (2分)
试题分析:A原子的价电子层的p轨道中只有1个电子,A原子最外层电子数为3;B、D元素的原子的p能级上都有1个未成对电子,D原子得一个电子填入3p轨道后,3p轨道已充满,D原子最外层电子数为7,B原子最外层电子数为3;C原子的p轨道中有3个未成对电子,C原子最外层电子数为5,E是同周期第一电离能最小的元素。综上所述:A是B;B是Al;C是P;D是Cl;E是K。
(1)A是B;B是Al;C是P。
(2)Cl的非金属性最强,K的金属性最强。
(3)D在第三周期,第一电离能最大,也就是失去最外层一个电子所需能力最大的元素是Cl;电负性最大,也就是最容易得到电子的元素是Cl。
(4)AD3是BCl3,B元素原子的原子轨道发生的是sp2杂化,分子空间构型为平面三角形。
(5)B是Al,E的最高价氧化物对应水化物是KOH,发生反应生成物中有此离子[B(OH)4]–离子方程式是2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑。
(6)化学式可写作CxK,由化合物的平面图形可知,K原子填充在石墨层中,选图中以K原子为顶点的任意一个三角形(如下图),可知K为3×(1/6),三角形内的C原子为4,C与K的原子数之比为8:1,则x=8,故答案为:8,化学式为KC8。
点评:本题考查位置、结构、性质的关系,难度较大,元素的推断是解答本题的关键,熟悉物质结构与性质是解答本题的关键。

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目




 NF3+3NH4F
NF3+3NH4F
 )具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。

 ,沸点
,沸点 ,在
,在 以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断GE3的晶体类型为________________。
以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断GE3的晶体类型为________________。 表示)的位置,在大正方体的棱、顶、面等处画出相应Si(用
表示)的位置,在大正方体的棱、顶、面等处画出相应Si(用 表示)的位置。
表示)的位置。