题目内容
【题目】研究化学反应的快慢和限度具有十分重要的意义。回答下列问题:
(1)反应2SO2(g) + O2(g)![]() 2SO3(g)是制备硫酸的重要反应,该反应为放热反应。降低温度,逆反应的速率_________;使用催化剂V2O5,正反应的速率__________ (以上填“增加”、“不变”或“减小”)。
2SO3(g)是制备硫酸的重要反应,该反应为放热反应。降低温度,逆反应的速率_________;使用催化剂V2O5,正反应的速率__________ (以上填“增加”、“不变”或“减小”)。
(2)常温下,实验室用100 mL 6.0 mol·L-1硫酸跟足量锌粉反应制取氢气。
①为降低反应进行的速率,又不影响生成氢气的量,可向反应物中加入____(填序号 )。
A.CH3COONa固体 B.KNO3固体
C.K2SO4溶液 D.KHSO4溶液
②向溶液中滴加少量硫酸铜溶液,反应速率加快,原因是___________________。
(3)一定温度下,在体积固定的密闭容器中,有色气体N与无色气体M的物质的量随时间变化曲线如图所示。反应达平衡的时间是____________,该反应的化学方程式可表示为______________________________,
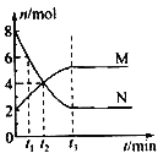
下列说法中能够判定该反应处于平衡状态的是______________(填 序号)
A.容器的压强不再变化 B.气体的颜色不再变化
C.每反应2 mol的N生成1 mol的M D.气体的密度不再发生变化
【答案】减小增加AC锌与硫酸铜反应置换出铜,铜、锌和稀硫酸三者形成原电池反应加快t32N![]() MAB
MAB
【解析】
(1)降低温度,正逆反应的速率都减小,使用催化剂,正逆反应的速率都增大,但对平衡状态无影响。 (2) ①A.加入CH3COONa固体,和硫酸反应生成的醋酸为弱酸,溶液中氢离子浓度减小,故会减缓反应进行的速率,但是酸所提供的氢离子的物质的量不变,所以不影响生成氢气的总量,故正确;B.加入KNO3固体,硝酸根离子在酸性条件下有强氧化性,与锌反应不生成氢气,所以生成氢气的总量减小,故错误;C.加入K2SO4溶液,硫酸的浓度减小,反应速率减小,但是氢气的总量不受影响,故正确;D.加入KHSO4溶液,氢离子增多,生成氢气的总量增多,故错误。故选 AC;②向溶液中滴加少量的硫酸铜溶液, 锌与硫酸铜反应置换出铜,铜、锌和稀硫酸三者形成原电池反应加快;(3)图中能够表明起始加入的物质是M和N,随反应进行,N的量逐渐减小,为反应物,M的量逐渐增多,为生成物,t3 时刻M、N的物质的量不变且不为0,则说明该反应为可逆反应且此时达到平衡,且N与M的物质的量变化量之比2:1,则反应的方程式为 2N![]() M。A.由于随着反应进行混合气体总物质的量发生变化,所以当容器的压强不再变化,可以说明反应到平衡,故正确;B.气体的颜色不再变化,说明有颜色的气体的物质的量不变,反应到平衡,故正确;C.每反应2 mol的N和生成1 mol的M都表示正反应速率,不能说明是否到平衡,故错误;D.混合气体的密度始终不随时间的变化而变化,所以密度不再发生变化,不能说明到平衡,故错误。故选AB。
M。A.由于随着反应进行混合气体总物质的量发生变化,所以当容器的压强不再变化,可以说明反应到平衡,故正确;B.气体的颜色不再变化,说明有颜色的气体的物质的量不变,反应到平衡,故正确;C.每反应2 mol的N和生成1 mol的M都表示正反应速率,不能说明是否到平衡,故错误;D.混合气体的密度始终不随时间的变化而变化,所以密度不再发生变化,不能说明到平衡,故错误。故选AB。