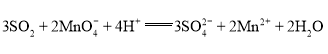题目内容
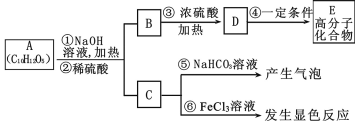
【题目】碱式氯化铝是某种高效净水剂的主要成分,实验室利用铝土矿(主要含Al2O3,还含少量Fe2O3、SiO2等杂质)制取碱式氯化铝的过程如下:

(1)溶解铝土矿需要使用质量分数为15%的盐酸,配制该盐酸所需的玻璃仪器有________
(2)盐酸溶解铝土矿的过程中,发生反应的离子方程式为____________(写一个即可),其目的是__________________________________________________________。
(3)从不引入杂质去考虑,调节溶液的pH时加入的物质最好为__________(填序号)。
A.NaOH B.Al C.氨水 D.Al2O3
(4)写出用pH试纸测定加入试剂X后所得溶液pH的操作:在白瓷板或玻璃片上放一小片pH试纸,________________________________________________,得出被测液的pH。
(5)实验室利用盐酸与大理石制取CO2的实验装置如图所示:

则各装置中导管从左到右的连接顺序为_________,装置C中盛放的试剂X为________。
【答案】量筒、烧杯、玻璃棒 Al2O3+6H+=2Al3++3H2O(或者Fe2O3+6H+=2Fe3++3H2O) 将铝土矿中的Al2O3及Fe2O3转化为可溶性盐,与SiO2分离 BD 用玻璃棒蘸取被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较 acdfeb 饱和NaHCO3溶液
【解析】
(1)根据物质的量浓度和质量分数的换算计算浓盐酸的质量分数,进而计算需要浓盐酸的体积,然后用量筒称量,并在烧杯中与一定量的水混合即可。需要使用量筒,烧杯,玻璃棒。
(2)根据盐酸能和氧化铝或氧化铁反应,而与二氧化硅不反应进行分析。
(3)调节溶液的pH同时不能引入新的杂质,所以选择本来就含有的铝元素的物质。
(4)根据pH的使用方法解答。
(5)根据盐酸和碳酸钙反应生成的二氧化碳含有水蒸气和氯化氢进行分析。
(1)配制一定质量分数的溶液,用到的玻璃仪器有量筒、烧杯、玻璃棒;
(2)用盐酸溶解是盐酸与氧化铝、氧化铁能反应生成可溶性盐,而二氧化硅不溶于盐酸,从而进行分离,反应的离子方程式为 Al2O3+6H+=2Al3++3H2O(或者Fe2O3+6H+=2Fe3++3H2O);
(3) 调节溶液的pH可以选择铝或氧化铝,不会引入新的杂质,故选 BD;
(4).测定溶液的pH方法是玻璃棒蘸取被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较;
(5)用盐酸和大理石制取的二氧化碳中含有水蒸气和氯化氢,应用饱和碳酸氢钠除去氯化氢,然后用浓硫酸除去水,故连接顺序为acdfeb。

【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A. 反应达到平衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z
2Z
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 升高温度平衡常数增大,则此反应为吸热反应
【题目】下列离子方程式能用来解释相应实验现象的是
实验现象 | 离子方程式 | |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 |
|
B | 向沸水中滴加饱和氯化铁溶液得到红褐色液体 |
|
C | 二氧化硫使酸性高锰酸钾溶液褪色 |
|
D | 氧化亚铁溶于稀硝酸 |
|
A. AB. BC. CD. D