题目内容
【化学——选修3:物质结构与性质】(15分)X、Y、Z、V、W为五种前四周期元素,其中X是短周期(除稀有气体外)原子半径最大的元素;Y与X同周期,其最高价氧化物的水化物呈两性;Z原子基态时2p原子轨道上有3个未成对的电子;V原子的核外电子排布式为ls22s22p63s2;W的原子序数为29,W的离子能与乙二胺(H2N—CH2一CH2一NH2)形成配离子:
回答下列问题:
(1)W原子的核外电子排布式为 ,该配离子中含有的化学键类型有 。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
(2)元素X、Y、V第一电离能由大到小的顺序是 (用元素符号表示)。
(3)Z的氢化物的空间构型是 ;该氢化物的沸点比甲烷的高,其主要原因是 ;Z的另一种氢化物Z2H4分子中Z原子轨道的杂化类型是 。
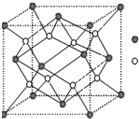
(4)X和Cl元素构成的化合物XCl,XCl的晶胞结构如右图所示,晶体中X+的配位数是 ;每个X+周围与其紧邻的Cl-围成的几何图形为 。
(1)[Ar]3d104s1(或1s22s22p63s23p63d104s1)(2分);abd(2分)
(2)Mg>Al>Na(2分)
(3)三角锥形(2分);氨分子间存在氢键(2分);sp3(2分)。
(4)6(1分);正八面体(2分)
解析:本题考查元素推断及物质结构的有关知识。由“X是短周期(除稀有气体外)原子半径最大的元素”可确定X是钠;“Y与X同周期,其最高价氧化物的水化物呈两性” 可确定Y是Al;由“Z原子基态时2p原子轨道上有3个未成对的电子”可确定Z是N;由“V原子的核外电子排布式为ls22s22p63s2”可确定V是Mg;由“W的原子序数为29”可确定W是Cu。
(1)W原子的核外电子排布式为[Ar]3d104s1(或1s22s22p63s23p63d104s1),该配离子中含有的化学键类型有配位键(Cu、N之间)、极性键(N、H与C、H之间)、非极性键(C、C之间),故选abd。(2)由于Mg存在3p全空特例,Mg的第一电离能比相邻元素都高,同周期,随原子序数增大,元素原子的第一电离能有增大的趋势,故Na 、Mg、Al第一电离能由大到小的顺序是Mg>Al>Na。(3)NH3中N采用sp3杂化,与H结合形成三角锥形,由于N半径小,电负性大,分子间可形成氢键,使NH3的沸点比CH4高,N的另一种氢化物N2H4分子中N原子轨道的杂化类型也是sp3杂化,分别N、H形成共价键。(4)从NaCl 的晶体结构可以看出,晶体中Na+的配位数是6(前后左右上下各一个Cl-)。每个Na+周围与其紧邻的Cl-围成的几何图形为正八面体()。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案已知:①A的简单阴离子核外有2个电子,B元素原子最外层电子数是内层电子数的3倍,E原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体,F元素原子序数为26.
②X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |
(1)B元素原子核外已成对电子数是未成对电子数的
(2)X、Y、Z的电负性从大到小的顺序为
(3)分子式为A2B、A2E的两种物质中
(4)X的氯化物的熔点比Y的氯化物的熔点
(5)F的氯化物FCl3与KSCN溶液反应显红色,该反应的离子方程式为
(6)F的一种常见配合物F(CO)3常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断F(CO)3的晶体类型为
【化学 ——选修3:物质结构】(15分)
氮元素可形成卤化物、叠氮化物及络合物等。
(1)NF3构型为三角锥形,沸点为-129 ℃;可在铜 催化作用下由F2和过量NH3反应得到。NF3属于________晶体.
催化作用下由F2和过量NH3反应得到。NF3属于________晶体.
(2)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N。
①与N互为等电子体的分子、离子有______、________(各举1例),由此可推知N的空间构型是______形。
②叠氮化物、氰化物能与Fe3+、Cu2+及Co3+等形成络合物,如Co[(N3)(NH3)5]SO4、[Fe(CN)6]4-。写出钴原子在基态时的价电子排布式:__________。如Co[(N3)(NH3)5]SO4、中钴的配位数为________,CN-中C原子的杂化类型是________。
(3)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)===2Na(l)+3N2(g),有关说法正确的是________(选填序号)。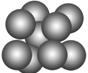
| A.NaN3与KN3结构类似,前者晶格能较小 |
| B.第一电离能(I1):N>P>S |
| C.钠晶胞结构如图,该晶胞分摊2个钠原子 |
| D.常温下,氮气很稳定,是因为氮的电负性小 |