题目内容
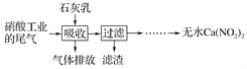
【题目】利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:
(1)一定条件下,NO与NO2可以生成一种新的氧化物,试写出该反应的化学方程式:___。
(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是__;滤渣可循环使用,滤渣的主要成分是__(填化学式)。
(3)该工艺需控制NO和NO2物质的量之比接近1∶1。
若n(NO)∶n(NO2)>1∶1,则会导致__;
若n(NO)∶n(NO2)<1∶1,则会导致__。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为__。
【答案】NO+NO2![]() N2O3 使尾气中的NO、NO2被充分吸收 Ca(OH)2 排放气体中NO含量升高 产品Ca(NO2)2中Ca(NO3)2含量升高 3NO2-+2H+=NO3-+2NO↑+H2O
N2O3 使尾气中的NO、NO2被充分吸收 Ca(OH)2 排放气体中NO含量升高 产品Ca(NO2)2中Ca(NO3)2含量升高 3NO2-+2H+=NO3-+2NO↑+H2O
【解析】
由流程可知,石灰乳和硝酸工业的尾气(含NO、NO2)反应,生成Ca(NO2)2,过量的石灰乳以滤渣存在,滤液为Ca(NO2)2溶液,经过一系列处理得到无水Ca(NO2)2。结合氮的氧化物的性质分析解答。
(1)若NO与NO2反应生成新的氧化物,必然是NO中N的化合价升高被氧化,NO2中N的化合价降低被还原,生成的新的氧化物中N的化合价应该介于+2和+4之间,为+3价,反应的化学方程式为NO+NO2![]() N2O3,故答案为:NO+NO2
N2O3,故答案为:NO+NO2![]() N2O3;
N2O3;
(2)气体上升液体下降,这样气液接触充分,使尾气中NO、NO2与石灰乳充分接触,NO、NO2被充分吸收;根据加入的原料及生成物,只有Ca(OH)2微溶于水,所以滤渣的主要成分为Ca(OH)2,故答案为:使尾气中NO、NO2被充分吸收;Ca(OH)2;
(3)若n(NO)∶n(NO2)>1∶1,则一氧化氮过量,排放气体中NO含量升高;若n(NO)∶n(NO2)<1∶1,则二氧化氮过量,二氧化氮可与石灰乳反应生成Ca(NO3)2,故答案为:排放气体中NO含量升高;产品Ca(NO2)2中Ca(NO3)2含量升高;
(4)依据化合价升降守恒,NO2-生成NO时氮元素化合价降低,则反应中一部分NO2-中氮元素的化合价一定升高,可能生成NO3-或NO2,但在水溶液中NO2会与水反应生成NO3-,所以最终产物为NO3-,即反应物是NO2-和H+,生成物是一氧化氮,硝酸根和水,反应的离子方程式为3NO2-+2H+=NO3-+2NO↑+H2O,故答案为:3NO2-+2H+=NO3-+2NO↑+H2O。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案【题目】合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)![]() CO2(g)+4H2(g)。
CO2(g)+4H2(g)。
已知下列键能数据:
化学键 | C—H | H—O | C=O | H—H |
键能/kJ·mol-1 | 414 | 464 | 803 | 436 |
则该反应的△H=( )
A.+162kJ·mol-1B.-766kJ·mol-1C.-162kJ·mol-1D.+1470kJ·mol-1
【题目】下表所列各组物质中,不能通过一步反应实现如图所示转化的是( )
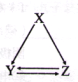
选项 | X | Y | Z |
A | AlCl3 | Al(OH)3 | NaAlO2 |
B | C | CO | CO2 |
C | CH2=CH2 | CH3CH2Br | CH3CH2OH |
D | S | SO2 | SO3 |
A.AB.BC..CD.D