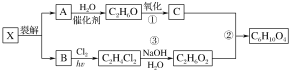
题目内容
【题目】氢气是一种清洁能源,又是合成氨工业的重要原料.已知氢气有多种制取方法:
①活泼金属![]() 如钠、钾
如钠、钾![]() 直接跟水反应;
直接跟水反应;
②金属![]() 如锌或铁或铝
如锌或铁或铝![]() 跟稀盐酸或稀硫酸反应;
跟稀盐酸或稀硫酸反应;
③电解水制氢气;
④由煤或焦炭跟水反应制取氢气:![]()
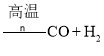 ;
;
⑤由天然气或重油制取氢气:![]()

![]() ;
;
(1)请你再补充一种制取氢气的方法,写出该反应的化学方程式 ______ .
(2)比较方法①和⑤: ______ g金属钠跟水反应与标准状况下![]()
![]() 跟水反应产生氢气的量相等.
跟水反应产生氢气的量相等.
(3)在甲、乙、丙3个容积均为2L的密闭容器中,于相同的温度下、使用相同的催化剂分别进行如下反应: 3H2(g)+N2(g) ![]() 2NH3(g),现按不同配比投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),现按不同配比投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 |
|
|
|
达到平衡的时间 |
| 5 | 8 |
| c |
| c |
|
|
|
|
混合气体密度 |
|
|
|
①分析表数据,下列关系正确的是 ______ ![]() 填写序号字母
填写序号字母![]() .
.
A.![]()
![]()
![]()
②在该温度下该反应的平衡常数![]() ______
______ ![]() 用含
用含![]() 的代数式表示
的代数式表示![]() .
.
(4)已知:![]() ;
;![]()
![]() ;
;![]()
则甲烷和![]() 反应生成
反应生成![]() 和
和![]() 的热化学方程式为 ______ .
的热化学方程式为 ______ .
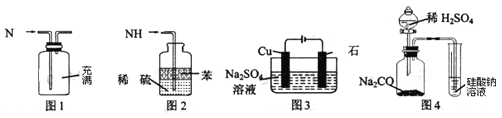
(5)如图所示装置工作时均与![]() 有关.
有关.
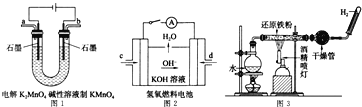
①图1所示装置中阳极的电极反应式为 ______ .
②图2所示装置中,通入![]() 的管口是 ______
的管口是 ______ ![]() 选填字母代号
选填字母代号![]() .
.
③某同学按图3所示装置进行实验,实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色.该同学据此得出结论:铁与水蒸气反应生成FeO和![]() 该结论 ______
该结论 ______ ![]() 填“严密”或“不严密”
填“严密”或“不严密”![]() ,你的理由是 ______
,你的理由是 ______ ![]() 用离子方程式表示
用离子方程式表示![]() .
.
【答案】![]() 69 AC
69 AC ![]()
![]()
![]() d 不严密
d 不严密 ![]()
【解析】
![]() 根据生成氢气的反应书写;
根据生成氢气的反应书写;
![]() 根据生成相同的氢气进行计算;
根据生成相同的氢气进行计算;
![]() 先将丙中的数据按照化学计量数转化成反应物氮气、氢气的物质的量,然后利用等效平衡知识进行分析;
先将丙中的数据按照化学计量数转化成反应物氮气、氢气的物质的量,然后利用等效平衡知识进行分析;
![]() 计算出反应前氮气、氢气的物质的量浓度,然后利用化学平衡三段式计算出达到平衡时各组分的浓度,最后根据化学平衡常数表达式计算出该温度下的平衡常数;
计算出反应前氮气、氢气的物质的量浓度,然后利用化学平衡三段式计算出达到平衡时各组分的浓度,最后根据化学平衡常数表达式计算出该温度下的平衡常数;
![]() 依据热化学方程式和盖斯定律计算得到所需热化学方程式;
依据热化学方程式和盖斯定律计算得到所需热化学方程式;
![]() 阳极上失电子发生氧化反应;
阳极上失电子发生氧化反应;
![]() 根据氢氧根离子的移动方向及氢气的反应判断氢气所在的电极;
根据氢氧根离子的移动方向及氢气的反应判断氢气所在的电极;
![]() 根据反应现象知,溶液中没有铁离子,原因是部分铁未被氧化,导致剩余的铁和铁离子反应生成亚铁离子.
根据反应现象知,溶液中没有铁离子,原因是部分铁未被氧化,导致剩余的铁和铁离子反应生成亚铁离子.
![]() 结合以上生成氢气的反应,还可以利用铝的两性来生成氢气,即反应方程式为
结合以上生成氢气的反应,还可以利用铝的两性来生成氢气,即反应方程式为![]()
![]()
![]()
![]()
![]() ,
,
故答案为:![]()
![]()
![]()
![]()
![]() ;
;
![]() 由反应
由反应![]() 标准状况下
标准状况下![]()
![]() 跟水反应产生氢气的物质的量为
跟水反应产生氢气的物质的量为![]()
又根据![]()
![]()
![]() ,要生成
,要生成![]() 氢气则需要钠3mol,故需要钠的质量为
氢气则需要钠3mol,故需要钠的质量为![]() ,
,
故答案为:69;
![]() 恒温、恒容条件下:
恒温、恒容条件下:
A.假设乙容器的容积为4L,则达到平衡时甲乙为等效平衡,各组分的含量、浓度相等,此时氮气的浓度为![]() ,然后将容器的容积缩小到2L,若平衡不移动,
,然后将容器的容积缩小到2L,若平衡不移动,![]() ,由于压强增大,平衡向着正向移动,氨气的浓度增大,所以
,由于压强增大,平衡向着正向移动,氨气的浓度增大,所以![]() ,故A正确;
,故A正确;
B.丙中2mol氨气相当于加入了1mol氮气、3mol氢气,而甲中为3mol![]() 、2mol
、2mol![]() ,由于丙反应物氮气的物质的量减小,生成的氨气的物质的量减小,所以
,由于丙反应物氮气的物质的量减小,生成的氨气的物质的量减小,所以![]() ,故B错误;
,故B错误;
C.反应前后都是气体,容器的容积都是2L,乙中混合气体的质量为甲的2倍,根据![]() 可知:
可知:![]() ,故C正确;
,故C正确;
故选AC;
![]() 甲容器中,反应前氢气浓度为:
甲容器中,反应前氢气浓度为:![]() ,氮气的浓度为:
,氮气的浓度为:![]() ,达到平衡时氮气的浓度变化为:
,达到平衡时氮气的浓度变化为:![]() ,
,
由化学平衡的三段式可得:
在该温度下甲容器中反应的平衡常数![]() ,
,
故答案为:![]() ;
;
![]()
![]()
![]() 得到
得到![]() ;
;
故答案为:![]() ;
;
![]() 阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为:
阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 氢氧燃料碱性电池中,氢气失电子和氢氧根离子反应生成水,图片中氢氧根离子向d电极移动,说明d电极上是氢气,故答案为:d;
氢氧燃料碱性电池中,氢气失电子和氢氧根离子反应生成水,图片中氢氧根离子向d电极移动,说明d电极上是氢气,故答案为:d;
![]() 铁和水蒸气在高温下反应生成四氧化三铁和氢气,根据反应现象知,该反应中部分铁未参加反应导致剩余的铁和铁离子反应生成二价铁离子,离子方程式为:
铁和水蒸气在高温下反应生成四氧化三铁和氢气,根据反应现象知,该反应中部分铁未参加反应导致剩余的铁和铁离子反应生成二价铁离子,离子方程式为:![]() ,所以说不严密,故答案为:不严密;
,所以说不严密,故答案为:不严密;![]() .
.

 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)![]() 2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
容器1 | 容器2 | 容器3 | |
应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2 mol SO2、1mol O2 | 4mol SO3 | 2 mol SO3 |
平衡v正(SO2)/molL-1S-1 | v1 | v2 | v3 |
平衡c(SO3)/molL-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
反应能量变化 | 放出a KJ | 吸收b KJ | 吸收c KJ |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常数K | K1 | K2 | K3 |
A. v1< v2,c2<2c1B. K1> K3,p2>2p3
C.v1< v3,α1(SO2 ) <α2(SO3 ) D. c2>2c3,α2(SO3 )+α3(SO2 )<1
【题目】在2L的恒容密闭容器中充入![]() 和
和![]() ,发生反应
,发生反应![]()
![]() ,实验内容和结果分别如表和图所示,下列说法不正确的是( )
,实验内容和结果分别如表和图所示,下列说法不正确的是( )
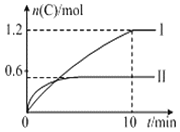
实验序号 | 温度 | 起始物质的量 | 热量变化 | |
A | B | |||
I |
| 1mol | 3mol | 96kJ |
II |
|
|
| |
A.实验Ⅰ中,10min内平均速率![]()
![]()
B.上述方程式中![]()
C.![]() 时,该反应的平衡常数是
时,该反应的平衡常数是![]()
D.向实验Ⅱ的平衡体系中再充入![]() molA和
molA和![]() molB,A的转化率增大
molB,A的转化率增大
【题目】如图①、②、③、④、⑤五组仪器(可重复使用),选择合适的装置和药品能完成的实验是( )
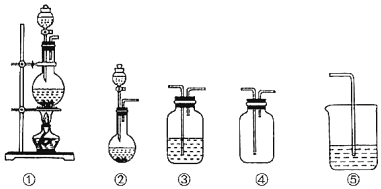
选项 | 实验目的 | 实验装置 | 实验药品 |
A | 制备并收集HCl气体 | ①③④ | 浓盐酸、浓硫酸、水 |
B | 比较氯气和溴的氧化性强弱 | ①③⑤ | MnO2、浓盐酸、饱和食盐水、溴化钾溶液、氢氧化钠溶液 |
C | 探究乙烯的加成反应 | ①③ | 无水乙醇、浓硫酸、溴的四氯化碳溶液 |
D | 探究二氧化硫的还原性 | ②③⑤ | 亚硫酸钠、30%的硝酸、溴水、氢氧化钠溶液 |
A.AB.BC.CD.D
【题目】有一无色透明溶液,欲确定是否含有下列离子:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,取该溶液的实验如下:
,取该溶液的实验如下:
实验步骤 | 实验现象 |
| 溶液变红色 |
| 有无色气体产生,气体遇空气可以变成红棕色 |
| 有白色沉淀生成 |
| 有稳定的白色沉淀生成,且不溶于稀硝酸 |
| 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
由此判断,下列说法正确的是![]()
A.根据实验![]() 可以确定溶液中不含有
可以确定溶液中不含有![]() 和
和![]() ,因为这二个离子相对应的酸为弱酸
,因为这二个离子相对应的酸为弱酸
B.溶液中一定存在的离子是![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ;溶液中肯定不存在的离子是:
;溶液中肯定不存在的离子是:![]() 、
、![]() 、
、![]() 、
、![]()
C.为进一步确定其它离子,应该补充焰色反应的实验来检验![]() 就可以
就可以
D.通过实验![]() 和
和![]() 就可以确定溶液中一定含有
就可以确定溶液中一定含有![]() ,一定不含有
,一定不含有![]() 、
、![]() 、
、![]() ,所以实验步骤
,所以实验步骤![]() 的设计是错误的
的设计是错误的