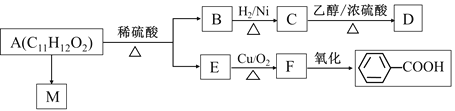
题目内容
【题目】在2L的恒容密闭容器中充入![]() 和
和![]() ,发生反应
,发生反应![]()
![]() ,实验内容和结果分别如表和图所示,下列说法不正确的是( )
,实验内容和结果分别如表和图所示,下列说法不正确的是( )
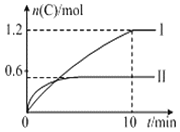
实验序号 | 温度 | 起始物质的量 | 热量变化 | |
A | B | |||
I |
| 1mol | 3mol | 96kJ |
II |
|
|
| |
A.实验Ⅰ中,10min内平均速率![]()
![]()
B.上述方程式中![]()
C.![]() 时,该反应的平衡常数是
时,该反应的平衡常数是![]()
D.向实验Ⅱ的平衡体系中再充入![]() molA和
molA和![]() molB,A的转化率增大
molB,A的转化率增大
【答案】B
【解析】
![]() 内C生成了
内C生成了![]() ,则反应速率
,则反应速率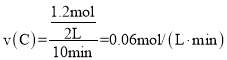 ,速率之比等于化学方程式计量数之比,
,速率之比等于化学方程式计量数之比,![]() =
=![]() ,故A正确;
,故A正确;
B. 反应焓变是指1molA全部反应的热量变化,则![]() ,图象分析,先拐先平温度高,温度越高C物质的量越小,温度升高,平衡逆向进行,说明反应是放热反应,所以
,图象分析,先拐先平温度高,温度越高C物质的量越小,温度升高,平衡逆向进行,说明反应是放热反应,所以![]() ,故B错误;
,故B错误;
C. 由A中可知平衡浓度:![]() ,
,![]() ,
,![]() ,平衡常数
,平衡常数![]() ,故C正确;
,故C正确;
D. 向实验Ⅱ的平衡体系中再充入![]() molA和
molA和![]() molB,二者物质的量为1:3,相当于在原来的基础增大压强,且通入B,则平衡正向移动,A的转化率增大,故D正确;
molB,二者物质的量为1:3,相当于在原来的基础增大压强,且通入B,则平衡正向移动,A的转化率增大,故D正确;
答案选B。

【题目】在2L恒容密闭容器中投入![]() 和
和![]() ,分别在温度
,分别在温度![]() 和
和![]() 下进行如下反应:
下进行如下反应:![]() ,且在
,且在![]() 温度下反应一段时间后改变某一个外界条件,测得
温度下反应一段时间后改变某一个外界条件,测得![]() 的物质的量
的物质的量![]() 与时间
与时间![]() 关系如下表所示,下列有关说法中错误的是( )
关系如下表所示,下列有关说法中错误的是( )
0 | 5min | 10min | 15min | 20min | 25min | |
| 2mol |
|
|
|
|
|
| 2mol |
|
|
|
|
|
A.![]()
B.![]()
C.![]() 温度下15min时改变的条件可能是加入一定量的He
温度下15min时改变的条件可能是加入一定量的He
D.![]() 温度下的平衡常数为12.96
温度下的平衡常数为12.96
【题目】![]() 时.体积均为
时.体积均为![]() 的两个恒容密闭容器中发生可逆反应:
的两个恒容密闭容器中发生可逆反应:![]()
![]() 实验测得反应在起始、达到平衡时的有关数据如表,下列叙述正确的是
实验测得反应在起始、达到平衡时的有关数据如表,下列叙述正确的是![]()
容器编号 | 起始时各物质物质的量 | 达到平衡时体系能量的变化 | ||
A | B | C | ||
| 2 | 1 | 0 |
|
|
|
|
| |
A.容器![]() 、
、![]() 中的平衡常数均为36
中的平衡常数均为36
B.向容器![]() 中通入氦气,平衡时A的转化率不变
中通入氦气,平衡时A的转化率不变
C.容器![]() 中达到平衡时放出的热量为/span>
中达到平衡时放出的热量为/span>![]() QkJ,达到平衡时,两个容器中C的物质的量浓度均为
QkJ,达到平衡时,两个容器中C的物质的量浓度均为![]()
![]()
D.其他条件不变,若容器![]() 保持恒容绝热,则达到平衡时C的体积分数小于
保持恒容绝热,则达到平衡时C的体积分数小于![]()
【题目】在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物![]() 如图所示
如图所示![]() ,发生反应:
,发生反应:![]() 保持温度不变,测得平衡时的有关数据如下:
保持温度不变,测得平衡时的有关数据如下:
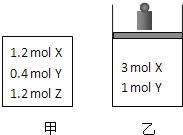
恒容容器甲 | 恒压容器乙 | |
Y的物质的量 |
|
|
Z的体积分数 |
|
|
下列说法正确的是![]()
A.平衡时容器乙的容积一定比反应前小
B.![]()
C.![]()
D.平衡时容器甲的压强一定比反应前大
【题目】氢气是一种清洁能源,又是合成氨工业的重要原料.已知氢气有多种制取方法:
①活泼金属![]() 如钠、钾
如钠、钾![]() 直接跟水反应;
直接跟水反应;
②金属![]() 如锌或铁或铝
如锌或铁或铝![]() 跟稀盐酸或稀硫酸反应;
跟稀盐酸或稀硫酸反应;
③电解水制氢气;
④由煤或焦炭跟水反应制取氢气:![]()
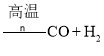 ;
;
⑤由天然气或重油制取氢气:![]()

![]() ;
;
(1)请你再补充一种制取氢气的方法,写出该反应的化学方程式 ______ .
(2)比较方法①和⑤: ______ g金属钠跟水反应与标准状况下![]()
![]() 跟水反应产生氢气的量相等.
跟水反应产生氢气的量相等.
(3)在甲、乙、丙3个容积均为2L的密闭容器中,于相同的温度下、使用相同的催化剂分别进行如下反应: 3H2(g)+N2(g) ![]() 2NH3(g),现按不同配比投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),现按不同配比投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 |
|
|
|
达到平衡的时间 |
| 5 | 8 |
| c |
| c |
|
|
|
|
混合气体密度 |
|
|
|
①分析表数据,下列关系正确的是 ______ ![]() 填写序号字母
填写序号字母![]() .
.
A.![]()
![]()
![]()
②在该温度下该反应的平衡常数![]() ______
______ ![]() 用含
用含![]() 的代数式表示
的代数式表示![]() .
.
(4)已知:![]() ;
;![]()
![]() ;
;![]()
则甲烷和![]() 反应生成
反应生成![]() 和
和![]() 的热化学方程式为 ______ .
的热化学方程式为 ______ .
(5)如图所示装置工作时均与![]() 有关.
有关.
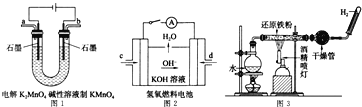
①图1所示装置中阳极的电极反应式为 ______ .
②图2所示装置中,通入![]() 的管口是 ______
的管口是 ______ ![]() 选填字母代号
选填字母代号![]() .
.
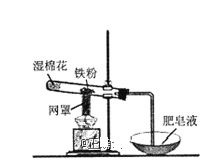
③某同学按图3所示装置进行实验,实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色.该同学据此得出结论:铁与水蒸气反应生成FeO和![]() 该结论 ______
该结论 ______ ![]() 填“严密”或“不严密”
填“严密”或“不严密”![]() ,你的理由是 ______
,你的理由是 ______ ![]() 用离子方程式表示
用离子方程式表示![]() .
.