题目内容
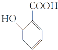
【题目】现有一混合物的水溶液,可能含有以下离子中的几种:![]() 、
、![]() 、
、![]() 、
、![]() 现取三份各100mL溶液进行如下实验:第一份加入
现取三份各100mL溶液进行如下实验:第一份加入![]() 溶液有沉淀A产生:第二份加足量NaOH溶液加热后,收集到0.08ml气体B;第三份加足量
溶液有沉淀A产生:第二份加足量NaOH溶液加热后,收集到0.08ml气体B;第三份加足量![]() 溶液后,得到干燥沉淀C 12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g
溶液后,得到干燥沉淀C 12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g
请回答以下问题
(1) 沉淀C的成分是_________,其物质的量分别是_____________
(2) 写出产生气体B的离子方程式 ____________________
(3) 该混合液中可能含的离子有___________,一定含有的阳离子有_________其物质的量分别是_____________一定没有的离子是_________________
【答案】硫酸钡、碳酸钡 ![]()
![]() Cl-
Cl- ![]()
![]()
![]()
【解析】
第一份加入AgNO3溶液有沉淀产生,与AgNO3溶液有沉淀产生,则至少含Cl-、CO32-、SO42-中的一种;
第二份加足量NaOH溶液加热产生气体,气体是氨气,溶液中一定含有NH4+,且物质的量为0.08mol;
第三份加入足量BaCl2溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g,可知不溶于盐酸的4.66g为硫酸钡,物质的量为![]() =0.02mol;12.54g沉淀是硫酸钡和碳酸钡,碳酸钡质量为12.54g-4.66g=7.88g,碳酸钡的物质的量为
=0.02mol;12.54g沉淀是硫酸钡和碳酸钡,碳酸钡质量为12.54g-4.66g=7.88g,碳酸钡的物质的量为![]() =0.04mol,故原溶液中一定存在CO32-、SO42-,则一定没有Ca2+、Ba2+;
=0.04mol,故原溶液中一定存在CO32-、SO42-,则一定没有Ca2+、Ba2+;
由电荷守恒可知,正电荷=n(NH4+)=0.08mol;负电荷=2c(CO32-)+2c(SO42-)=0.12mol,正电荷总物质的量大于负电荷,故原溶液中一定有K+,至少为0.04mol,以此来解答。
(1).第三份加入足量BaCl2溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g,可知不溶于盐酸的4.66g为硫酸钡,物质的量为![]() =0.02mol;12.54g沉淀是硫酸钡和碳酸钡,碳酸钡质量为12.54g-4.66g=7.88g,碳酸钡的物质的量为
=0.02mol;12.54g沉淀是硫酸钡和碳酸钡,碳酸钡质量为12.54g-4.66g=7.88g,碳酸钡的物质的量为![]() =0.04mol, 沉淀C的成分是硫酸钡、碳酸钡,
=0.04mol, 沉淀C的成分是硫酸钡、碳酸钡,
答案为:硫酸钡、碳酸钡;n(BaCO3)=0.04mol,n(BaSO4)=0.02mol;
(2) 由第二份加足量NaOH溶液加热后,收集到0.08ml气体B可知,![]() ,
,
答案为:![]() ;
;
(3) 第二份加足量NaOH溶液加热产生气体,气体是氨气,溶液中一定含有NH4+,且物质的量为0.08mol;由电荷守恒可知,正电荷为:n(NH4+)=0.08mol;负电荷=2c(CO32-)+2c(SO42-)=0.12mol,正电荷总物质的量大于负电荷,故原溶液中一定有K+,至少为0.04mol,该混合液中可能含的离子有Cl-,故原溶液中一定存在CO32-、SO42-、K+、NH4+,一定没有Ca2+、Ba2+,可能含的离子有Cl-,
故答案为:Cl-;K+、NH4+;![]() ;Ca2+、Ba2+。
;Ca2+、Ba2+。

 名校课堂系列答案
名校课堂系列答案