题目内容
12.常温下,下列关于电解质溶液的说法正确的是( )| A. | 将pH=4的CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 | |
| B. | 用CH3COOH溶液滴定等物质的量浓度NaOH溶液至pH=7,V(CH3COOH)<V(NaOH)溶液 | |
| C. | 向0.2mol/L的盐酸溶液中加入等体积0.1mol•L-1的NH3•H2O溶液:c(Cl-)+c(OH-)=c(H+)+c(NH3•H2O) | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-) |
分析 A、醋酸溶液加水稀释时,溶液酸性减弱;
B、醋酸与NaOH恰好中和时,溶液显碱性;
C、向0.2mol/L的盐酸溶液中加入等体积0.1mol•L-1的NH3•H2O溶液,得到相同物质的量浓度的氯化铵和盐酸的混合溶液;
D、NaHSO4能够完全电离,结合电荷守恒判断.
解答 解:A、将pH=4的CH3COOH溶液加水稀释10倍,溶液酸性减弱,碱性增强,氢氧根离子浓度增大,故A错误;
B、醋酸钠溶液显碱性,若用CH3COOH溶液滴定等物质的量浓度NaOH溶液至pH=7,V(CH3COOH)>V(NaOH)溶液,故B错误;
C、向0.2mol/L的盐酸溶液中加入等体积0.1mol•L-1的NH3•H2O溶液,得到相同物质的量浓度的氯化铵和盐酸的混合溶液,据电荷守恒c(Cl-)+c(OH-)=c(H+)+c(NH4+),c(NH4+)>c(NH3•H2O),故C错误;
D、NaHSO4是强电解质能够完全电离,NaHSO4=H++SO42-+Na+,溶液中c(Na+)=c(SO42-),据电荷守恒有c(Na+)+c(H+)=2c(SO42-)+c(OH-),则c(H+)=c(SO42-)+c(OH-),故D正确;
故选D.
点评 本题考查了醋酸加水稀释时酸性减弱、盐类水解的应用、电荷守恒的应用,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.下列离子方程式书写正确的是( )
| A. | 向偏铝酸钠溶液中滴加过量盐酸:AlO2-+H++H2O=A1(OH)3↓ | |
| B. | 碳酸氢钠溶液与少量的石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 向三氯化铁溶液中加入过量铜屑:2Fe3++3Cu=2Fe+3Cu2+ | |
| D. | 用NaOH溶液吸收少量Cl2气体:OH-+Cl2=Cl-+HClO |
20.下列有关实验操作设计、现象记录、结论解释都正确的是( )
| 实验操作设计 | 现象记录 | 结论解释 | |
| A | 将少量浓硝酸逐滴加入Cu 和稀硫酸的混合物中 | 产生红棕色气体 | 硝酸被还原为NO2 |
| B | 用坩埚钳夹住铝箔在酒精灯 上加热 | 铝箔熔化但并不滴落 | 熔点:Al2 O3>Al |
| C | 向某氯化亚铁溶液中加入 Na2O2粉末 | 出现红褐色沉淀 | 加入Na2O2粉末前,原氯化 亚铁溶液已经变质 |
| D | 向紫色石蕊试液中持续长时 间通人氯气 | 溶液先变红,最后变 为无色 | 氯气有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
7.下列各组所有的元素组合,既可形成离子化合物,又可形成共价化合物的是( )
| A. | H、C、O、Na | B. | H、K、O、S | C. | H、O、S | D. | H、N、O |
4.下列有关原子核外电子排布的说法正确的是( )
| A. | 原子核外的电子总是尽先排在能量高的电子层里,然后才排在能量低的电子层 | |
| B. | 某原子的核电荷数与最外层电子数相等 | |
| C. | 原子核外的电子层分为七层,每层所排的电子数相同 | |
| D. | 某原子M层上电子数是L层上电子数的4倍 |
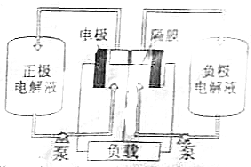 偏钒酸铵(NH4VO3)为白色或微黄色的晶体粉末,微溶于水和氨水,而难溶于冷水,在钒的湿法冶金中占重要地位.
偏钒酸铵(NH4VO3)为白色或微黄色的晶体粉末,微溶于水和氨水,而难溶于冷水,在钒的湿法冶金中占重要地位.
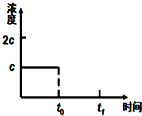 请你利用所学反应原理知识解决下列问题:
请你利用所学反应原理知识解决下列问题: