题目内容
(12分)在容积为5L的密闭容器中,通入5 mol N2和8 mol H2,在一定条件下反应生成NH3,当反应进行到2 min时,测得容器内有4 mol NH3。则:

 (1)2 min时,容器内n(N2)== ,c(H2)== 。
(1)2 min时,容器内n(N2)== ,c(H2)== 。
(2)2 min内,以N2表示的平均反应速率v(N2)== 。

 (3)2 min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为:
(3)2 min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为:

 (1)2 min时,容器内n(N2)== ,c(H2)== 。
(1)2 min时,容器内n(N2)== ,c(H2)== 。(2)2 min内,以N2表示的平均反应速率v(N2)== 。

 (3)2 min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为:
(3)2 min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为:(1)3 mol;0.4mol·l-1(各3分)
(2)0。2mol·L-1·min-1(3分)
(3)9:13(3分)
(2)0。2mol·L-1·min-1(3分)
(3)9:13(3分)
考查可逆反应的有关计算。在可逆反应的计算中往往采用三段式进行列式计算,即根据反应式分别列出起始量、转化量和平衡(或某时刻)量,然后根据已知条件列式即可。
N2 + 3H2 2NH3
2NH3
起始量(mol) 5 8 0
转化量(mol) 2 6 4
2min后(mol) 3 2 4
所以2min时容器内氮气的物质的量为3mol
氢气的浓度为
以N2表示的平均反应速率v(N2)=
容器内气体的总物质的量与反应前容器内气体的总物质的量之比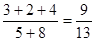
N2 + 3H2
 2NH3
2NH3起始量(mol) 5 8 0
转化量(mol) 2 6 4
2min后(mol) 3 2 4
所以2min时容器内氮气的物质的量为3mol
氢气的浓度为

以N2表示的平均反应速率v(N2)=

容器内气体的总物质的量与反应前容器内气体的总物质的量之比

练习册系列答案
相关题目
 ,下列说法错误的是( )
,下列说法错误的是( )
 2C(g)若经2 s 后测得C的浓度为0.6 mol/L,下列几种说法正确的是
2C(g)若经2 s 后测得C的浓度为0.6 mol/L,下列几种说法正确的是
 2NH3(g);△H<0
2NH3(g);△H<0 2SO2(g)+O2(g);△H>0
2SO2(g)+O2(g);△H>0 pC(g) + qD(g),当m、n、p、q为任意整数(不为零)时, 能说明达到平衡状态的标志是
pC(g) + qD(g),当m、n、p、q为任意整数(不为零)时, 能说明达到平衡状态的标志是 C(g) +D(g) 发生过程中的能量变化如图,△H表示反应的焓变。下列说法正确的是( )
C(g) +D(g) 发生过程中的能量变化如图,△H表示反应的焓变。下列说法正确的是( )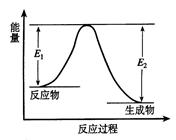
 Y(g)+2Z(g),△H>0,在某温度时X的浓度随时间变
Y(g)+2Z(g),△H>0,在某温度时X的浓度随时间变
 2 NH3达到平衡的标志是( )
2 NH3达到平衡的标志是( )