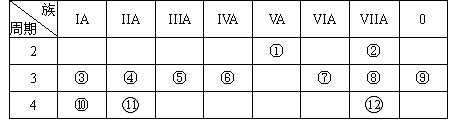
题目内容
现有下列9种微粒: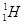 、
、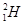 、
、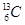 、
、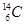 、
、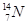 、
、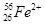 、
、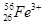 、
、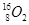 、
、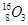 。按要求完成以下各题:
。按要求完成以下各题:
(1) 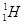 、
、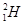 、
、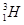 分别是氢元素的一种 ,它们互称为 。
分别是氢元素的一种 ,它们互称为 。
(2)互为同素异形体的微粒是 。
(3)对于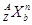 ,按下列要求各举一例(要求:每小题分别写出符合题意的两种粒子,且从以上所给微粒中选择):
,按下列要求各举一例(要求:每小题分别写出符合题意的两种粒子,且从以上所给微粒中选择):
①Z、n、b相同而A不同: ;
②A、n、b相同而Z不同: ;
③A、Z、b相同而n不同: ;
④Z、n、A相同而b不同: 。
(1)核素 同位素
(2)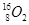 和
和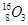
(3)①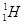 、
、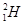 (或
(或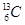 、
、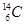 ) ②
) ②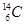 、
、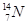 ③
③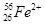 、
、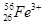 ④
④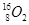 、
、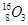
解析

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案(12分)甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/L盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
①写出下列实验报告中的实验现象和离子方程式
②【评价】甲同学设计的实验方案的合理性是___________(填序号)
A. 非常合理 B. 部分合理 C. 完全不合理
③【补充和完善】上一题②中若选A,则此项不用再作答,若选B或C,则完成实验还需要的试剂是___________。
(2)探究影响化学反应速率的因素
| 实验步骤 | 实验现象 | 实验依据和结论 |
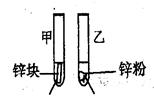 3mL1mol/L 3mL3mol/L 盐酸 盐酸 (金属质量相同,盐酸均过量) | 均有气体生成,锌粉先消失,锌块后消失 | 因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快。 |
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性。画出实验装置图,标出正负极、电子流动方向,写出电极反应式。
X、Y、Z、W、T是元素周期表中前四周期的五种元素。有关这五种元素的信息如下表:
| 元素代号 | 相关信息 |
| X | 它的一种核素的原子核内没有中子 |
| Y | 能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素 |
| Z | 基态原子的最外层电子排布式为nsnnpn+1 |
| W | 与钠元素能组成两种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞” |
| T | 主要化合价有+1和+2价,其二价离子在水溶液中呈蓝色 |
请推出具体元素,用化学用语回答下列问题:
(1)写出W元素在周期表中的位置____________。写出T元素的基态电子排布式________________。
(2)在这五种元素中电负性最大的是________,Y Z W三种元素的第一电离能顺序为_______________。
(3)由X Z 两种元素可以形成一种ZX5的既含离子键又含共价键的化合物,其电子式为__________。
(4)TW在高温条件下是一种优良的氧化剂,它能将很多有机化合物完全氧化(相当于完全燃烧),写出高温条件下,TW与Y最简单的氢化物反应的化学方程式:_______________________________________。
(5)已知在25℃、101 kPa下:
XYZ(aq)+X2W(1)
 YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol
YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/molX3W+(aq)+WX(aq)=2X2W(1) ΔH="-57.3" KJ/mol
则在25℃、101 kPa的稀溶液中,XYZ与WX反应的热化学方程式(以离子方程式表示) :_________。