题目内容
【题目】以电石渣为原料制备KClO3的流程如图:
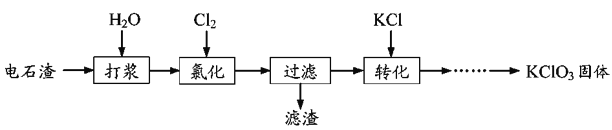
(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为________。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有________(填序号)。
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O,氯化完成后过滤。
①滤渣的主要成分为_______(填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2]:n(CaCl2)___1:5(填“>”、“<”或“=”)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100 gL-1,从该溶液中尽可能多地析出KClO3固体的方法是_______。
【答案】2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O AB CaCO3、Ca(OH)2 < 蒸发浓缩、冷却结晶
【解析】
电石渣中含有Ca(OH)2,加入水打浆,通入氯气,可生成Ca(ClO)2,Ca(ClO)2进一步转化为Ca(ClO3)2,过滤后在滤液中加入KCl转化生成KClO3,经蒸发浓缩、冷却结晶可得晶体KClO3。
(1)①氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O;
②提高Cl2转化为Ca(ClO3)2的转化率,可使氯气和氢氧化钙充分接触,可适当减缓通入Cl2速率、充分搅拌浆料,因氢氧化钙微溶于水,加水溶解的做法不可取,因浓度过低,对后续实验不利,故合理选项是AB;
(2)①氯化过程中发生氧化还原反应:6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O,生成的Ca(ClO3)2溶于水,由于电石渣中含有的CaCO3不溶于水,Ca(OH)2微溶于水,则滤渣中含有CaCO3、Ca(OH)2;
②氯化过程中Cl2与氢氧化钙反应中,还有一部分反应生成Ca(ClO)2和CaCl2,则n[Ca(ClO3)2]:n(CaCl2)<1:5;
(3)要从该溶液中尽可能多地析出KClO3固体,应通过蒸发浓缩、冷却结晶的方法。

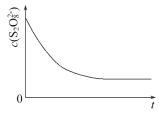
【题目】碘在科研与生活中有重要应用,某兴趣小组用0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知S2O82-+2I-=2SO42-+I2(慢) I2+2S2O32-= 2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的___耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为n(S2O32-)∶n(S2O82-)___。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如表
实验序号 | 体积V/mL | ||||
K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx__mL,理由是___。
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)____