题目内容
3.由Mg、P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,请回答下列问题.(1)基态Mg原子L层电子排布式为2s22p6,P、S、Cl的第一电离能由大到小顺序为Cl>P>S.
(2)PH4Cl的电子式为
 ,Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为1:1.
,Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为1:1.(3)SCl2分子中的中心原子杂化轨道类型是sp3,该分子构型为V形或折线形.
(4)已知MgO与NiO的晶体结构(如图1)相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm.则熔点:MgO>NiO(填“>”、“<”或“=”),理由是离子所带电荷相同,Mg2+半径比Ni2+小,所以MgO的晶格能比NiO大,MgO熔点高.
(5)如图1所示,NiO晶胞中离子坐标参数A为(0,0,0),B为(1,0,1),则C离子坐标参数为(1,$\frac{1}{2}$,$\frac{1}{2}$).

(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图2),已知O2-的半径为a m,每平方米面积上分散的该晶体的质量为$\frac{75}{2\sqrt{3}{a}^{2}•{N}_{A}}$g.(用a、NA表示)
分析 (1)Mg位处周期表中第3周期,IIA族,L层电子排布式为2s22p6,第一电离能同周期元素随着原子序数增大呈现增大的趋势,但第VA族出现反常,其第一电离能大于相邻原子;
(2)N和P为同主族元素,联系NH4Cl的电子式写出PH4Cl的电子式,CO中含有1根σ键,2根π键,配位键也属于共价键,也为σ键;
(3)根据VSEPR理论和杂化轨道理论判断SCl2分子中的中心原子杂化轨道类型和分子构型;
(4)同为离子晶体,考虑晶格能对熔点的影响,晶格能越大,熔点越高;
(5)根据立体几何知识和已知的原子坐标,写出C的原子坐标;
(6)先取出平面NiO的基本结构单元,计算基本结构单元的面积,最后计算每平方米面积上分散的该晶体的质量.
解答 解:(1)Mg位处周期表中第3周期,IIA族,L层电子排布式为2s22p6,第一电离能同周期元素随着原子序数增大呈现增大的趋势,但第VA族出现反常,其第一电离能大于相邻原子,则P、S、Cl的第一电离能由大到小顺序为:Cl>P>S,
故答案为:Cl>P>S;
(2)N和P为同主族元素,联系NH4Cl的电子式写出PH4Cl的电子式,将N换成P,则PH4Cl的电子式为: ,Ni与CO能形成配合物Ni(CO)4,CO中含有1根σ键,2根π键,配位键也属于共价键,也为σ键,该分子中σ键为:1×4+4=8与π键个数为:2×4=8,为1:1,
,Ni与CO能形成配合物Ni(CO)4,CO中含有1根σ键,2根π键,配位键也属于共价键,也为σ键,该分子中σ键为:1×4+4=8与π键个数为:2×4=8,为1:1,
故答案为: ;1:1;
;1:1;
(3)对于SCl2,根据VSEPR理论,中心S原子的配位原子数为BP=2,孤电子对数为LP=$\frac{6-2×2}{2}=2$,则价电子对数为VP=BP+LP=2+2=4,根据杂化轨道理论,中心S原子的杂化方式为sp3,有两对孤对电子,则其分子构型为V形或折线形,
故答案为:sp3;V形或折线形;
(4)MgO与NiO的晶体结构(如图1)相同,同为离子晶体,晶格能越大,熔点越高,Mg2+和Ni2+的离子半径分别为66pm和69pm,离子半径小,电荷越高,晶格能越大,则熔点MgO>NiO,
故答案为:>;离子所带电荷相同,Mg2+半径比Ni2+小,所以MgO的晶格能比NiO大,MgO熔点高;
(5)根据NiO的晶胞结构,已知原子坐标A(0,0,0),B(1,0,1),C在右侧面心处,根据立体几何知识,则C的原子坐标为(1,$\frac{1}{2}$,$\frac{1}{2}$),
故答案为:(1,$\frac{1}{2}$,$\frac{1}{2}$);
(6)根据单分子层结构,先取出基本结构单元,平面NiO的基本结构单元为 ,面积为:2a×2a×sin60°=2$\sqrt{3}{a}^{2}$,则每平方米含有的NiO质量为$\frac{75}{2\sqrt{3}{a}^{2}•{N}_{A}}$,
,面积为:2a×2a×sin60°=2$\sqrt{3}{a}^{2}$,则每平方米含有的NiO质量为$\frac{75}{2\sqrt{3}{a}^{2}•{N}_{A}}$,
故答案为:$\frac{75}{2\sqrt{3}{a}^{2}•{N}_{A}}$.
点评 本题考查物质结构知识,包含电子排布式的书写,第一电离能大小的比较,电子式的书写,价键类型的判断,价层电子对互斥理论,杂化轨道理论,晶格能的知识,原子坐标的书写,晶胞的计算,考查知识较为综合,有助于培养综合分析问题的能力,题目难度中等.

 口算题天天练系列答案
口算题天天练系列答案| A. | 熔点:金刚石>晶体硅>冰>干冰 | B. | 电负性:N>O>F | ||
| C. | 熔点:CsCl>MgO>Na>K | D. | 沸点:C2H5SH>C2H5OH>CH3SH |
| A. | 蒸馏 | B. | 升华 | C. | 浸取 | D. | 分液 |
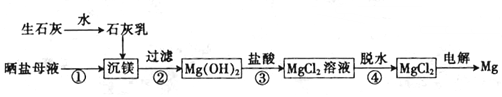
下列说法错误的是( )
| A. | 上述工艺流程中未涉及置换反应 | |
| B. | 设计步骤①、②、③的主要目的是富集MgCl2 | |
| C. | 脱水时在HCl气氛中进行可防止MgCl2发生水解 | |
| D. | 电解得到的炽热镁粉可在二氧化碳气氛中冷却 |
| A. | CH2═CH2+Br2→CH2Br-CH2Br | B. | B、CH3CH2OH+3O2$\stackrel{点燃}{→}$2CO2+3H2O | ||
| C. |  | D. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl |

| A. | 从海水中提取溴,一般要经历浓缩、氧化、还原富集和再氧化等步骤 | |
| B. | 利用溴的挥发性,鼓入热空气或水蒸气,就可将溴吹出来 | |
| C. | 第②步发生反应的离子方程式为:SO2+Br2+2H2O═4H++2Br-+SO42- | |
| D. | 要除去产品溴中的少量氯气,可依次加入NaOH溶液及苯 |
| A. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| B. | 聚乙烯可发生加成反应 | |
| C. | 油脂为高分子化合物 | |
| D. | 符合分子式C5H12的物质有4种 |
| A. | 三种溶液pH的大小顺序是③>②>① | |
| B. | 若将三种溶液稀释相同倍数,pH变化最大的是② | |
| C. | 若三种溶液的pH均为11,则物质的量浓度的大小顺序是③>①>② | |
| D. | 若分别加入25mL等物质的量浓度的盐酸后,pH最大的是① |