题目内容
硝酸工业尾气中的氮的氧化物(NO、NO2)是主要的大气污染物之一,其常用的治理方法有以下几种:①NaOH溶液吸收法,反应原理如下:
2NO2+2NaOH====NaNO2+NaNO3+H2O
NO2+NO+2NaOH====2NaNO2+H2O
②氨催化还原法,反应原理是:
NOx+NH3![]() N2+H2O
N2+H2O
现有一定量的含NO2和NO的HNO3工业尾气(不含其他气体),若用过量的NaOH溶液吸收后,溶液中NaNO3与NaNO2的物质的量之比恰好与尾气中NO和NO2的物质的量之比相等。
(1)若用NOx表示该尾气中氮的氧化物的平均组成,试求x的值。
(2)若1体积的该尾气用氨催化还原法处理,至少消耗多少体积相同状况下的氨气?
答案:
解析:
提示:
解析:
| (1)x=
|
提示:
| 设该尾气中含a mol
NO2、b mol NO,则据题中所给的信息,必有b molNO与b mol NO2共同与NaOH反应,生成2b mol NaNO2。
NO+NO2+2NaOH====2NaNO2+H2O b b 2b 参加反应的NO (a-3b)(a+b)=0,则a=3b,即a:b=3:1。 因为:n(NO 由反应式:NOx+NH3 12 12 14 1 V(NH3) V(NH
|

练习册系列答案
相关题目
 ,
, )是主要的大气污物,其常用的治理方法有以下两种(已经简化).
)是主要的大气污物,其常用的治理方法有以下两种(已经简化).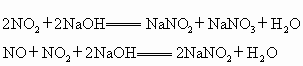

 与
与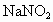 的物质的量之比恰好与尾气中NO和
的物质的量之比恰好与尾气中NO和 表示该尾气中氮的氧化物的平均组成,计算x值.
表示该尾气中氮的氧化物的平均组成,计算x值.