题目内容
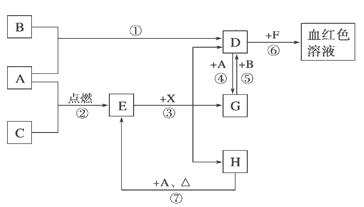
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应。
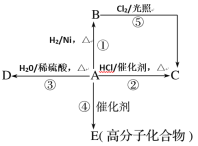
根据如图回答下列问题:
(1)写出B、D的结构简式:B___;D___。
(2)写出②⑤两步反应的化学方程式,并注明反应类型:
②__(反应类型__)。
⑤__(反应类型__)。
(3)戊烷的同分异构体中,在相同条件下沸点最低的是__(写结构简式),其系统命名为:___。
【答案】CH3CH3 CH3CH2OH CH2=CH2+HCl![]() CH3CH2Cl 加成反应 CH3CH3+Cl2
CH3CH2Cl 加成反应 CH3CH3+Cl2![]() CH3CH2Cl+HCl 取代反应
CH3CH2Cl+HCl 取代反应 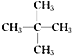 2,2-二甲基丙烷
2,2-二甲基丙烷
【解析】
烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,则A为CH2=CH2;A与HCl发生加成反应生成C则C为CH3CH2Cl,A与氢气发生加成反应生成CH3CH3,乙烷与氯气发生取代反应生成CH3CH2Cl;A与水发生加成反应生成D,则D为CH3CH2OH;A发生加聚反应生成E为聚乙烯。
(1)根据分析可知B为CH3CH3;D为CH3CH2OH;
(2)②为乙烯与HCl的加成反应,方程式为:CH2=CH2+HCl![]() CH3CH2Cl;
CH3CH2Cl;
⑤为乙烷与氯气的取代反应,方程式为CH3CH3+Cl2![]() CH3CH2Cl+HCl;
CH3CH2Cl+HCl;
(3)碳原子数相同的烃类支链越多熔沸点越低,所以戊烷的同分异构体中,在相同条件下沸点最低的是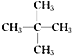 ,系统命名为2,2-二甲基丙烷。
,系统命名为2,2-二甲基丙烷。

【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。反应Ⅰ:CO(g)+2H2(g) ![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
温度 | 250 ℃ | 300 ℃ | 350 ℃ |
K | 2.0 | 0.27 | 0.012 |
(1)由表中数据判断ΔH1________(填“>”、“<”或“=”)0;反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH3=___________(用ΔH1和ΔH2表示)。
CO(g)+H2O(g) ΔH3=___________(用ΔH1和ΔH2表示)。
(2)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是________(填字母序号)
A.充入CO,使体系总压强增大 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.使用高效催化剂
(3)保持恒温恒容条件对于反应Ⅱ:将10 mol CO2和30mol H2放入1 L的密闭容器中,充分反应后测得CO2的转化率为60%,则该反应的平衡常数为____________________。若维持条件不变向该容器中投入10 mol CO2、30mol H2、10 mol CH3OH(g)和 10mol H2O(g),判断平衡移动的方向是________(填“正向移动”、“逆向移动”或“不移动”)。
(4)反应Ⅰ的逆反应速率与时间的关系如图所示。由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件:t2时_______________________;t8时______________________________。