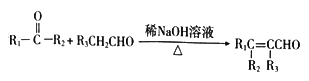
题目内容
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对比中学常见元素周期表,分析其元素的填充规律,判断下列说法正确的是

A.③元素形成的单质晶体均属于原子晶体
B.②、⑦、⑧对应的简单离子半径依次减小
C.②⑤形成的化合物阴阳离子个数比可能为1∶1
D.④元素的气态氢化物易液化,是因为其分子间存在氢键
【答案】D
【解析】本题考查了元素周期表及应用的相关知识。由元素在周期表中的位置可知,①为H、②为Na、③为C、④为N、⑤为O、⑥为P、⑦为S、⑧为Cl。A.碳单质中金刚石为原子晶体,石墨为混合晶体,而C60为分子晶体,故A错误;B.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2>Cl>Na+,故B错误;C.Na2O与Na2O2中阴阳离子个数比均为1∶2,故C错误;D.氨气分子之间存在氢键,分子间作用力较大,容易液化,故D正确;故选D。

练习册系列答案
相关题目
【题目】短周期元素甲~戊在元素周期表中的相对位置如下表所示,下列判断正确的是( )
甲 | 乙 | |
丙 | 丁 | 戊 |
A. 原子半径:甲>乙
B. 原子核外电子层数:乙<丁
C. 原子最外层电子数:丙>丁>戊
D. 元素的最高价氧化物对应水化物的碱性:丙<戊