题目内容
【题目】下列说法中正确的是( )
A. 氨分子是三角锥形,而甲烷是正四面体形,是因为NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
B. 杂化轨道全部参加形成化学键
C. PCl5分子中P原子和Cl原子最外层都满足8电子结构
D. 在 分子中含有2个手性C原子
分子中含有2个手性C原子
【答案】A
【解析】
A项、氨分子中氮原子的价层电子对数为4,孤对电子数为1,杂化轨道为sp3杂化,孤对电子对成键电子的排斥作用较强,N-H之间的键角小于109°28′,所以氨气分子空间构型是三角锥形;甲烷分子中碳原子的价层电子对数为4,孤对电子数为0,杂化轨道为sp3杂化,碳原子连接4个相同的原子,C-H之间的键角相等为109°28′,故CH4为正四面体构型,故A正确;
B项、杂化轨道可以部分参加形成化学键,例如氨分子中氮原子杂化轨道为sp3杂化,形成了4个sp3杂化轨道,但是只有3个参与形成化学键,故B错误;
C项、在化合物中,原子最外层电子数等于原子的价层电子数+|化合价|,PCl5中P原子的最外层电子为:5+5=10,Cl原子的最外层电子为:7+|-1|=8,不都满足8电子稳定结构,故C错误;
D项、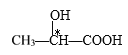 分子中,带*号碳原子所连的四个取代基分别是羟基、甲基、氢原子和羧基,该碳原子具有手性,分子中含有1个手性C原子,故D错误。
分子中,带*号碳原子所连的四个取代基分别是羟基、甲基、氢原子和羧基,该碳原子具有手性,分子中含有1个手性C原子,故D错误。
答案选A。

【题目】废旧电池的回收处理,既能减少对环境的污染,又能实现资源的再生利用。将废旧锌锰电池初步处理后,所得废料含MnO2、MnOOH、Zn(OH)2及少量Fe等,用该废料制备Zn和MnO2的一种工艺流程如下:
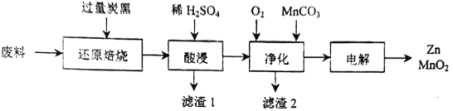
已知:
①Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化
②有关Ksp数据如下表所示
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-13 | 10-17 | 10-38 |
回答下列问题:
(1)还原焙烧过程中, MnOOH与炭黑反应,锰元素被还原为MnO,该反应的化学方程式为___________。传统的工艺是使用浓盐酸在加热条件下直接处理废料,缺点是___________。
(2)酸漫时一般会适当加热并不断搅拌,其作用是___________,滤渣1和滤渣2主要成分的化学式依次是___________。
(3)净化时,先通入O2再加入MnCO3,其目的是___________;已知净化时溶液中Mn2+、Zn2+的浓度约为0.1mol·L-1,调节pH的合理范围是___________。
(4)电解制取MnO2时,MnO2在___________极产生。
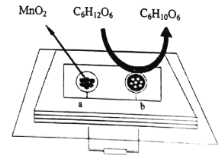
(5)中科院研究人员将MnO2和生物质置于一个由滤纸制成的折纸通道内形成电池,该电池可将软饮料中的葡萄糖作为燃料获得能量,装置如图所示。此装置中b极的电极反应式为______________________。