题目内容
19.草酸亚铁晶体(FeC2O4•2H2O)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料,也常用作分析试剂及显影剂等,其制备流程如下:
(1)配制(NH4)2Fe(SO4)2•6H2O溶液时,需加少量硫酸,目的是抑制Fe2+水解.
(2)沉淀时发生反应的化学方程式为(NH4)2Fe(SO4)2+H2C2O4+2H2O=FeC2O4•2H2O↓+H2SO4+(NH4)2SO4.
(3)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液的颜色由紫红色变为棕黄色,同时有气体生成.这说明草酸亚铁晶体具有还原(填“氧化”或“还原”)性.若反应中消耗1mol FeC2O4•2H2O,则参加反应的n(KMnO4)为0.6 mol.
(4)称取3.60g草酸亚铁晶体(摩尔质量是180g•mol-1)用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如图所示:
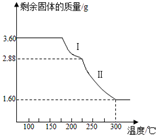
①过程Ⅰ发生反应的化学方程式为FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeC2O4+2H2O.
②300℃时剩余固体是铁的一种氧化物,试通过计算确定该氧化物的化学式草酸亚铁晶体中的铁元素质量为:3.6g×$\frac{56}{180}$×100%=1.12g,草酸亚铁晶体中的铁元素完全转化到氧化物中,
氧化物中氧元素的质量为:1.60g-1.12g=0.48g,
铁元素和氧元素的质量比为:1.12g:0.48g=7:3,
设铁的氧化物的化学式为FexOy,
则有:56x:16y=7:3,
x:y=2:3,
铁的氧化物的化学式为Fe2O3.(写出计算过程).
分析 在稀硫酸溶液中配置硫酸亚铁氨,加入草酸沉淀沉淀亚铁离子生成草酸亚铁,静置倾去上层溶液后处理得到草酸晶体,
(1)配制(NH4)2Fe(SO4)2•6H2O溶液时,需加少量硫酸的目的是抑制其水解;
(2)沉淀时发生反应硫酸亚铁氨溶液中加入草酸反应生成草酸亚铁沉淀、硫酸和硫酸氨;
(3)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到CO2生成.说明草酸亚铁被氧化为铁离子、二氧化碳气体,草酸亚铁具有还原性,依据电子守恒计算得到消耗的高锰酸钾物质的量;
(4)根据图中提供的信息,通过计算可以判断反应的化学方程式和物质的化学式;
①过程Ⅰ发生的反应是:草酸亚铁晶体受热失去结晶水;
②草酸亚铁晶体中的铁元素质量为:3.6g×$\frac{56}{180}$×100%=1.12g,草酸亚铁晶体中的铁元素完全转化到氧化物中,
氧化物中氧元素的质量为:1.60g-1.12g=0.48g,
铁元素和氧元素的质量比为:1.12g:0.48g=7:3,
据此计算书写化学式.
解答 解:(1)配制(NH4)2Fe(SO4)2•6H2O溶液时,溶液中亚铁离子水解显酸性,需加少量硫酸的目的是抑制其水解,
故答案为:抑制Fe2+水解;
(2)沉淀时发生反应硫酸亚铁氨溶液中加入草酸反应生成草酸亚铁沉淀、硫酸和硫酸氨,反应的化学方程式依据原子守恒配平写出为:(NH4)2Fe(SO4)2+H2C2O4+2H2O=FeC2O4•2H2O↓+H2SO4+(NH4)2SO4,
故答案为:(NH4)2Fe(SO4)2+H2C2O4+2H2O=FeC2O4•2H2O↓+H2SO4+(NH4)2SO4;
(3)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到CO2生成.说明草酸亚铁被氧化为铁离子、二氧化碳气体,草酸亚铁具有还原性,依据电子守恒计算得到消耗的高锰酸钾物质的量,依据氧化还原反应电子守恒原子守恒配平书写离子方程式为5Fe2++5C2O42-+3MnO4-+24H+=5Fe3++3Mn2++5CO2↑+12H2O,消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol;
故答案为:还原性;0.6;
(4)①通过剩余固体的质量可知,过程Ⅰ发生的反应是:草酸亚铁晶体受热失去结晶水,反应的化学方程式为:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeC2O4+2H2O
故答案为:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeC2O4+2H2O;
②草酸亚铁晶体中的铁元素质量为:3.6g×$\frac{56}{180}$×100%=1.12g,草酸亚铁晶体中的铁元素完全转化到氧化物中,
氧化物中氧元素的质量为:1.60g-1.12g=0.48g,
铁元素和氧元素的质量比为:1.12g:0.48g=7:3,
设铁的氧化物的化学式为FexOy,
则有:56x:16y=7:3,
x:y=2:3,
铁的氧化物的化学式为Fe2O3.
故答案为:Fe2O3.
点评 本题考查了铁及其化合物性质的实验验证和实验分析判断,定量计算,图象分析是解题关键,题目难度较大.

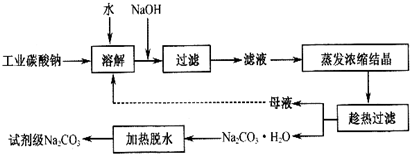
有关物质的溶度积如表:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
(1)碳酸钠是制造普通玻璃的主要原料,请写出制造普通玻璃过程中发生的化学反应方程式SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑.
(2)上述提纯过程中加入NaOH溶液时,反应的离子方程式为Fe3++3OH-=Fe(OH)3↓,MgCO3+2OH-=Mg(OH )2+CO32-;当溶液的pH=8时,溶液中c(Mg 2+):c(Fe3+)=2.125×1021.
(3)“母液”中除了含有 Na+、CO32-离子外,还含有Cl-、SO42-等离子.
(4)有人从“绿色化学”角度设想将“母液”直接进行循环使用.请你分析实际工业生产中是否可行不可行(填“可行”或“不可行”)并说明理由若“母液”循环使用,则溶液中 c(Cl-)和c(SO42-)增大,最后所得产物
Na2 CO3混有杂质.
(5)试剂级碳酸钠的检验标准为:纯度≥99.5%,为了检验提纯后的碳酸钠是否达标,实验室称取1.06g样品,溶于水配制成100mL溶液,量取20.00mL,滴入2滴甲基橙作为指示剂,用0.1000mol/L的标准盐酸进行滴定,三次滴定后使用盐酸的平均体积为39.84mL,请计算,该样品碳酸钠的纯度为99.6%.

| A. | 可用溴水区分化合物Ⅱ和化合物Ⅲ | |
| B. | 化合物Ⅰ中所有原子可能在同一平面 | |
| C. | 化合物Ⅰ、Ⅱ、Ⅲ均能与NaHCO3溶液发生反应 | |
| D. | 1 mol化合物Ⅰ最多能与3 mol H2发生加成反应 |
2H2(g)+S2(g)?2H2S(g) K1;△H1 (Ⅰ)
3H2(g)+SO2(g)?2H2O(g)+H2S(g) K2;△H2 (Ⅱ)
(1)用△Hl、△H2表示反应4H2(g)+2SO2(g)?S2(g)+4H2O(g)的△H=△H2×2-△H1
(2)回答下列反应(I)的相关问题:
①温度为T1,在1L恒容容器中加入1.8molH2、1.2molS2,10min时反应达到平衡.测得10min内v(H2S)=0.08mol•L-1•min-1,则该条件下的平衡常数为0.8L•mol-1,若此时再向容器中充入H2(g)、S2(g)、H2S(g)各0.8mol,则平衡移动方向为正向(填“正向”、“逆向”或“不移动”);
②温度为T2时T2>T1,在1L恒容容器中也加入1.8molH2(g)、1.2molS2(g),反应建立平衡时测得S2(g)的转化率为25%,据此判断△H1<0(填“>”或“<”),与T1时相比,平衡常数K2减小(填“增大”、“减小”或“不变”).
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等.
①已知Na2SO3水溶液显碱性,原因是SO32-+H2O?HSO3-+OH-(写出主要反应的离子方程式),该溶液中,c(Na+)<2c(SO32-)+c(HSO3-)+c(OH-)(填“>”、“<”或“='’).
②在某NaHSO3、Na2SO3混合溶液中,HSO3-和SO32-物质的量之比与溶液pH变化如下表所示(部分):
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
| A. | 离子键、σ键 | B. | 极性键、离子键 | C. | 离子键 | D. | 离子键、π键 |
| A. | COS分子是含有极性键的极性分子 | |
| B. | COS的电子式为: | |
| C. | COS的分子中所有原子满足8电子稳定结构 | |
| D. | COS分子中三个原子处于同一直线上 |
 某学生实验小组,用稀硫酸和稀氢氧化钠溶液在如图所示的装置中,进行中和反应反应热的测定.请回答下列问题:
某学生实验小组,用稀硫酸和稀氢氧化钠溶液在如图所示的装置中,进行中和反应反应热的测定.请回答下列问题: