题目内容
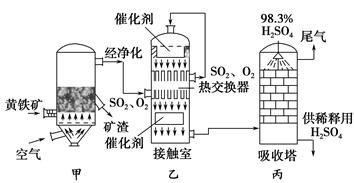
下列有关工业生产叙述正确的是
| A.工业上通常使用电解法制备金属钠、镁、铝等 |
| B.合成氨工业中,将NH3及时液化分离有利于加快反应速率 |
| C.硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高 |
| D.电解精炼铜时,将粗铜与电源的负极相连 |
A
解析试题分析:A、正确,电解熔融的NaCl制备金属Na,电解熔融的MgCl2制备Mg,电解熔融的氧化铝制备Al ;B、不正确,合成氨工业中,将NH3及时液化分离有利于提高氨的转化率;C、不正确,选择400℃~500℃,反应速率和平衡转化率都较高,如温度过高,转化率反而降低,常压下,平衡转化率较高,如增大压强,会造成设备造价和耗能增加,在此温度下,反应速率和平衡转化率都较高;常压下,平衡转化率较高,且不会因加压造成设备造价和耗能增加;D、不正确,电解精炼铜时,将粗铜与电源的正极相连。选A。
考点:工业生产

 新编小学单元自测题系列答案
新编小学单元自测题系列答案(6分)(2012?重庆)化学工业是国民经济的支柱产业.下列生产过程中不涉及化学变化的是( )
| A.氮肥厂用氢气和氮气合成氨 | B.钢铁厂用热还原法冶炼铁 |
| C.硫酸厂用接触法生产硫酸 | D.炼油厂用分馏法生产汽油 |
下列关于化工生产的叙述中,符合目前工业生产实际的是
| A.石油工业中,采用干馏的方法把石油分成不同沸点范围的产品 |
| B.硝酸工业中,为了加快氨氧化的速率,通常使用铁触媒作催化剂 |
| C.纯碱工业中,氨碱法通过氨气和二氧化碳的循环利用,提高了原料的利用率 |
| D.合成氨工业中,采用高压条件,增大合成氨反应的平衡常数,增大原料转化率 |
现代工业上用氨与二氧化碳在高压下反应,先生成氨基甲酸铵,再脱水生成尿素。反应式为2NH3+CO2 NH2COONH4;NH2COONH4
NH2COONH4;NH2COONH4 CO(NH2)2+H2O
CO(NH2)2+H2O
根据已学知识推断起固氮作用的化学反应是( )
| A.NO2与H2O的反应生成HNO3和NO | B.NO与O2反应生成NO2 |
| C.NH3经催化氧化生成NO | D.N2 蛋白质 蛋白质 |
下列关于化工生产原理的叙述中,均符合目前工业生产实际的是
| A.氯碱工业中,氢氧化钠在电解槽的阴极区产生 |
| B.氯气和氢气混合在光照条件下生成氯化氢,用水吸收得到盐酸 |
| C.二氧化硫在接触室被氧化成三氧化硫,三氧化硫在吸收塔内被水吸收制成浓硫酸 |
| D.合成氨工业中,利用氨易液化,分离出N2、H2循环使用,总体上提高了氨的产率 |
【化学--选修2化学与技术】(15分)
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下: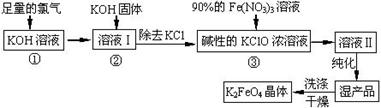
已知:2KOH + Cl2 ═ KCl + KClO + H2O(条件:温度较低)
6KOH + 3Cl2 ═ 5KCl + KClO3 + 3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺反应①应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体( 该溶液的密度为1.47 g/mL),它
的物质的量浓度为 ;
(5)在“溶液I”中加KOH固体的目的是 :
| A.与 “溶液I” 中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供反应物 |
| D.使副产物KClO3转化为 KClO |
(7)如何判断K2FeO4晶体已经洗涤干净 。
下面是人们对于化学科学的各种常见认识,其中错误的是( )。
| A.化学将在能源、资源的合理开发和安全应用方面大显身手 |
| B.化学是在被运用于破坏环境而没有治理环境污染 |
| C.化学是一门具有极强实用性的科学 |
| D.化学是一门以实验为基础的自然科学 |