题目内容
12.实验室制氯气的反应如下:4HCl(浓)+MnO2$\stackrel{△}{→}$MnCl2+Cl2↑+2H2O
能否使用制氯化氢的装置来制氯气?为什么?
分析 实验室制备氯化氢的反应原理为:H2SO4(浓)+NaCl$\frac{\underline{\;\;△\;\;}}{\;}$HCl+NaHSO4,依据反应条件和反应物状态选择发生装置,据此解答.
解答 解:依据实验室制备氯化氢的反应原理为:H2SO4(浓)+NaCl$\frac{\underline{\;\;△\;\;}}{\;}$HCl+NaHSO4,用到的仪器为固体与液体加热制备气体,而实验室制氯气的:
4HCl(浓)+MnO2$\stackrel{△}{→}$MnCl2+Cl2↑+2H2O,用到的原料也是固体与液体反应条件为加热,所以可以用相同发生装置制备,
故答案为:能够;因为用到的原料都固体与液体,反应条件都需要加热.
点评 本题考查了气体的制备,明确反应物状态和反应条件是选择发生装置的依据是解题关键,题目难度不大.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
17.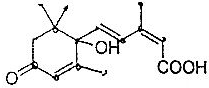 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,关于该分子说法正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,关于该分子说法正确的是( )
 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,关于该分子说法正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,关于该分子说法正确的是( )| A. | 含有碳碳双键、羟基、醛基、羧基 | |
| B. | 可以发生加成、加聚、取代、氧化等反应 | |
| C. | 含有2个手性碳原子 | |
| D. | S-诱抗素制剂的分子式为C15H20O4 |
4.已知CH30H(1)的燃烧热为-726kJ•mol-1下列对于反应2CH30H(1)+3O2(g)═2CO2(g)+4H2O(?)△H=-1452kJ•mol-1中水的状态判断正确的是( )
| A. | 气态 | B. | 液态 | C. | 固态 | D. | 无法判断 |
2.用含有A12O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O.工艺流程如下:

已知:①一定条件下,MnO4 -可与Mn2+反应生成MnO2
②部分金属阳离子生成氢氧化物沉淀的pH如下表:
③常温下,Fe(OH)3:Ksp=1.1×10-36,Fe(OH)2:Ksp=1.64×10-14,Al(OH)3:Ksp=1.3×10-33
(1)H2SO4溶解A12O3的离子方程式是Al2O3+6H+=2Al3++3H2O
(2)检验滤液中存在Fe3+的方法是取少量滤液于试管,滴加KSCN溶液,溶液变为红色,则滤液中有Fe3+(注明试剂、现象).
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.7;
(Ⅱ)加热,产生大量红褐色沉淀,静置,上层溶液呈紫红色;
(Ⅲ)加入MnSO4至紫红色消失,过滤.
①步骤Ⅰ的目的:将Fe2+氧化为Fe3+;调节溶液的pH为3.7的目的是调节pH值使铁元素沉淀完全,此时溶液中c(Fe3+)为1.1×10-5.1mol•L-1
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成有黄绿色气体,写出其反应方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
③Ⅲ中加入MnSO4的目的是除去过量的MnO4-.
(4)从多次循环使用后母液中可回收的主要物质是K2SO4(填化学式)

已知:①一定条件下,MnO4 -可与Mn2+反应生成MnO2
②部分金属阳离子生成氢氧化物沉淀的pH如下表:
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.8 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.7 |
(1)H2SO4溶解A12O3的离子方程式是Al2O3+6H+=2Al3++3H2O
(2)检验滤液中存在Fe3+的方法是取少量滤液于试管,滴加KSCN溶液,溶液变为红色,则滤液中有Fe3+(注明试剂、现象).
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.7;
(Ⅱ)加热,产生大量红褐色沉淀,静置,上层溶液呈紫红色;
(Ⅲ)加入MnSO4至紫红色消失,过滤.
①步骤Ⅰ的目的:将Fe2+氧化为Fe3+;调节溶液的pH为3.7的目的是调节pH值使铁元素沉淀完全,此时溶液中c(Fe3+)为1.1×10-5.1mol•L-1
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成有黄绿色气体,写出其反应方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
③Ⅲ中加入MnSO4的目的是除去过量的MnO4-.
(4)从多次循环使用后母液中可回收的主要物质是K2SO4(填化学式)
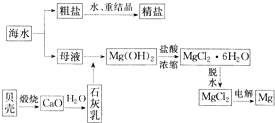 海水的综合利用可以制备金属镁,其流程如图所示:
海水的综合利用可以制备金属镁,其流程如图所示: