题目内容
9.下列分子或离子中,含有孤对电子的是( )| A. | NH4+ | B. | CO2 | C. | SiH4 | D. | CH4 |
分析 孤对电子是指未参与形成化学键的成对电子,对于孤对电子的判定:主要是看与中心原子成键的配位原子数,一般中心原子达8电子稳定结构时,最外层上有4对电子,当与中心原子成键的配位原子少于4个时,中心原子就会有孤对电子存在,配位原子为4个或多于4个时,则中心原子则不会有孤对电子存在了.
解答 解:A、NH4+中N最外层有5个电子,有4对共用电子对,因而没有孤对电子,故A错误;
B、CO2中O最外层有6个电子,只有2对共用电子对,因而各含有2对孤对电子,故B正确;
C、SiH4中O中Si最外层有4个电子,有4对共用电子对,因而没有孤对电子,故C错误;
D、CH4中O中C最外层有4个电子,有4对共用电子对,因而没有孤对电子,故D错误;
故选B.
点评 本题主要考查了孤对电子的判断,掌握判断方法是解题的关键,难度中等.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
19.下列有关晶体的叙述中,不正确的是( )
| A. | 金刚石的网状结构中,由共价键形成的碳原子环,其中最小的环上有6个碳原子 | |
| B. | 30克SiO2晶体中含有2molSi-O键 | |
| C. | 干冰晶体熔化时,1mol干冰要断裂2mol碳氧双键 | |
| D. | 石墨中,C原子与C-C键数目之比为2:3 |
17.下列原子核外电子排布最外层电子数为2的是( )
| A. | Al | B. | Mg | C. | Na | D. | H |
4.NH4H与NH4 Cl的结构相似,又知NH4H与水反应有H2生成,下列叙述不正确的是( )
| A. | NH4H是离子化合物 | |
| B. | NH4H溶于水,所形成的溶液显酸性 | |
| C. | NH4H与水反应时,NH4H是还原剂 | |
| D. | NH4H固体投入少量的水中,有两种气体生成 |
14.(1)图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A氯化铯;B氯化钠;C二氧化硅;D金刚石(或晶体硅).
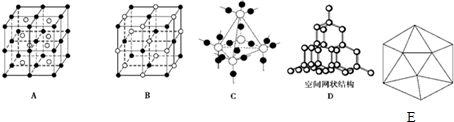
(2)单质硼有无定形和晶体两种,参考下表数据,回答问题.
①晶体硼的晶体类型是原子晶体,理由是熔、沸点很高、硬度很大.
②已知晶体的基本结构单元都是由硼原子组成的正二十面体,其中含20个等边三角形和一定数目的顶角,每个顶角上各有一个原子,试观察上图,回答:这个基本结构单元由12个硼原子组成,其中B-B键的键角是60°,共含有30个B-B键.

(2)单质硼有无定形和晶体两种,参考下表数据,回答问题.
| 金刚石 | 晶体硅 | 晶体硼 | |
| 熔点/K | >3 823 | 1 683 | 2 573 |
| 沸点/K | 5 100 | 2 628 | 2 823 |
| 硬度/Moh | 10 | 7.0 | 9.5 |
②已知晶体的基本结构单元都是由硼原子组成的正二十面体,其中含20个等边三角形和一定数目的顶角,每个顶角上各有一个原子,试观察上图,回答:这个基本结构单元由12个硼原子组成,其中B-B键的键角是60°,共含有30个B-B键.
1.下列各组有机物中,其一氯代物的数目不相等的是( )
| A. | 正戊烷和正己烷 | B. | 苯和乙烷 | ||
| C. | 对二甲苯和2,2-二甲基丙烷 | D. | 甲苯和2-甲基丁烷 |
 翡翠的主要成分为NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅.
翡翠的主要成分为NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅.