题目内容
14.(1)图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A氯化铯;B氯化钠;C二氧化硅;D金刚石(或晶体硅).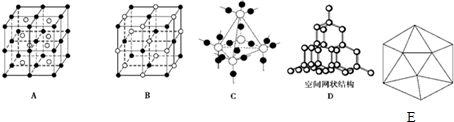
(2)单质硼有无定形和晶体两种,参考下表数据,回答问题.
| 金刚石 | 晶体硅 | 晶体硼 | |
| 熔点/K | >3 823 | 1 683 | 2 573 |
| 沸点/K | 5 100 | 2 628 | 2 823 |
| 硬度/Moh | 10 | 7.0 | 9.5 |
②已知晶体的基本结构单元都是由硼原子组成的正二十面体,其中含20个等边三角形和一定数目的顶角,每个顶角上各有一个原子,试观察上图,回答:这个基本结构单元由12个硼原子组成,其中B-B键的键角是60°,共含有30个B-B键.
分析 (1)根据晶体结构模型判断物质的种类;
(2)根据表中数据判断可知晶体硼熔沸点和硬度介于金刚石和晶体硅之间,判断为原子晶体;
(3)在硼原子组成的正二十面体结构中,每5个面共用一个顶点,每个面拥有这个顶点的$\frac{1}{5}$,每个等边三角形拥有的顶点为:$\frac{1}{5}$×3=$\frac{3}{5}$,20个等边三角形拥有的顶点为:$\frac{3}{5}$×20=12;B-B键组成正三角形,则每个键角均为60°;每2个面共用一个B-B键,每个面拥有这个B-B键的$\frac{1}{2}$,每个等边三角形占有的B-B键为:$\frac{1}{2}$×3=$\frac{3}{2}$,20个等边三角形拥有的B-B键为:$\frac{3}{2}$×20=30,据此答题;
解答 解:(1)由晶胞结构模型可知A、B、C、D分别为氯化铯、氯化钠、二氧化硅、金刚石(或晶体硅),
故答案为:氯化铯;氯化钠;二氧化硅;金刚石(或晶体硅);
(2)根据表中数据判断可知晶体硼熔沸点和硬度介于金刚石和晶体硅之间,熔沸点、硬度都很大,可知晶体硼为原子晶体,
故答案为:原子晶体,熔、沸点很高、硬度很大;
(3)在硼原子组成的正二十面体结构中,每5个面共用一个顶点,每个面拥有这个顶点的$\frac{1}{5}$,每个等边三角形拥有的顶点为:$\frac{1}{5}$×3=$\frac{3}{5}$,20个等边三角形拥有的顶点为:$\frac{3}{5}$×20=12;B-B键组成正三角形,则每个键角均为60°;每2个面共用一个B-B键,每个面拥有这个B-B键的$\frac{1}{2}$,每个等边三角形占有的B-B键为:$\frac{1}{2}$×3=$\frac{3}{2}$,20个等边三角形拥有的B-B键为:$\frac{3}{2}$×20=30,
故答案为:12、60°、30;
点评 本题考查了晶体的有关性质,主要考查了晶体类型的判断及晶体的物理性质,侧重考查学生分析问题、解决问题的能力,题目难度不大.

 口算能手系列答案
口算能手系列答案| A. | 金刚石为网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| B. | 氯化钠晶体中,每个Na+周围距离相等的Na+共有12个 | |
| C. | 干冰晶体中,每个CO2分子周围紧邻12个CO2分子 | |
| D. | 金属铜属于六方最密堆积结构,金属镁属于面心立方最密堆积结构 |
| A. | 鸦片 | B. | 海洛因 | C. | 冰毒 | D. | 苯甲酸钠 |
| A. | NH4+ | B. | CO2 | C. | SiH4 | D. | CH4 |
| A. | Al(OH)3 是医用胃酸中和剂的一种,它的碱性不强,不至于对胃壁产生强烈的刺激或腐蚀作用,但却可以与酸反应,使胃液pH降低,起到中和胃酸的作用. | |
| B. | 铝表面的氧化膜可以防止铝制品被进一步氧化,但是很多酸碱盐可以直接侵蚀铝表面的氧化膜以及铝制品本身,因此铝制品不宜用来蒸煮或长时间存放酸性、碱性或咸的食物 | |
| C. | 移动电话及笔记本电脑中使用的锂离子电池,聚合物锂离子电池等一系列新型二次电池具有供电方便,工作寿命长、自放电率低,记忆效应高等特点 | |
| D. | 很多金属及其化合物在灼烧时会使火焰呈现特殊的颜色,这种化学反应叫做焰色反应,节日燃放的五彩缤纷的烟花就是碱金属以及锶、钡等金属化合物的焰色反应所呈现的各种艳丽色彩 |
①O2 ②Cl2 ③F2 ④H2 ⑤NaOH溶液 ⑥H2O.
| A. | ①②③ | B. | ①②③⑤ | C. | ③⑤ | D. | 除⑥外 |
| A. | 铝的化学性质稳定 | B. | 铝与氧气常温下不反应 | ||
| C. | 铝是两性元素 | D. | 铝与氧化合形成一层致密的氧化膜 |
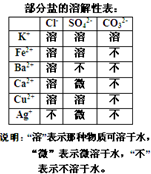 某混合物澄清透明的水溶液中,可能含有以下离子中若干种:K+、Ca2+、Fe2+、Cu2+、Cl-、CO32-、SO42-,现每次取该溶液100.00mL溶液进行以下实验:
某混合物澄清透明的水溶液中,可能含有以下离子中若干种:K+、Ca2+、Fe2+、Cu2+、Cl-、CO32-、SO42-,现每次取该溶液100.00mL溶液进行以下实验: