题目内容
14.0.1mol/LCH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+对于该平衡,下列叙述正确的是( )| A. | 加入水时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$减小 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 加入少量0.1mol/LHCl溶液,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
分析 醋酸是弱电解质,溶液中存在电离平衡,醋酸的电离是吸热反应,升高温度促进醋酸电离,向溶液中加入和醋酸根离子或氢离子反应的物质促进醋酸电离,加入含有氢离子或醋酸根离子的物质抑制醋酸电离,加水稀释促进电离.
解答 解:A、加水稀释,平衡促进醋酸电离,酸性减弱,氢离子浓度减小,醋酸的电离平衡常数不变,所以$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$增大,故A错误;
B、向溶液中加入少量氢氧化钠固体,氢氧根离子和氢离子反应促进醋酸电离,则平衡向正反应方向移动,故B正确;
C、向溶液中加入0.1mol/L的盐酸,盐酸中氢离子浓度大于醋酸,导致混合溶液中氢离子浓度增大,故C错误;
D、向溶液中加入少量醋酸钠固体,醋酸根离子浓度增大,抑制醋酸电离,则醋酸的电离程度减小,故D错误;
故选B.
点评 本题考查了弱电解质的电离,明确哪些条件能促进醋酸电离哪些条件抑制醋酸电离,注意弱电解质电离是吸热反应,为易错点.

练习册系列答案
相关题目
4.下列说法正确的是:( )
| A. | 2014年1月4日,国家首次将雾霾天气纳入自然灾情进行通报.雾霾也是一种分散系,分散剂为空气 | |
| B. | 氯化氢溶于水的过程中虽然有H-Cl键的断裂,但没有新化学键的形成,所以该过程是物理过程 | |
| C. | 2014年12月某市某化工市场发生爆炸,据调查为化工原料“醋酸乙烯”燃烧所致,该化工原料属于烯烃 | |
| D. | 2014年的诺贝尔化学奖授予了超高分辨率荧光显微镜的发展者,该技术突破了光学显微镜的极限,能观察到纳米尺度的微粒,该技术还可以将研究反应速率的时间分辨率达到纳秒级水平 |
5.下列反应的离子方程式书写正确的是( )
| A. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
2.分离下列物质的方法错误的是( )
| A. | 酒精和水:用蒸馏的方法分离 | |
| B. | 碘和四氯化碳:用水萃取碘 | |
| C. | 水和苯:用分液漏斗分液 | |
| D. | 氯化钠与硝酸钾:先溶于水再用结晶的方法分离 |
9.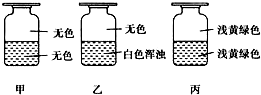 向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如图所示,则甲、乙、丙注入的液体分别是( )
向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如图所示,则甲、乙、丙注入的液体分别是( )
①AgNO3溶液 ②NaOH溶液 ③水.
 向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如图所示,则甲、乙、丙注入的液体分别是( )
向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如图所示,则甲、乙、丙注入的液体分别是( )①AgNO3溶液 ②NaOH溶液 ③水.
| A. | ①②③ | B. | ②①③ | C. | ③②① | D. | ①③② |
19.下列关于能层与能级的说法中正确的是( )
| A. | 1个原子轨道里最多只能容纳2个电子,但自旋方向相同 | |
| B. | 任一能层的能级总是从s能级开始,以f能级收尾,而且能级数等于该能层序数 | |
| C. | 同是s能级,在不同的能层中所能容纳的最多电子数是不相同的 | |
| D. | 钠原子核外共有11种运动方式不同的核外电子 |
3.某有机物是药物生产的中间体,其结构简式如图.下列有关叙述不正确的是( )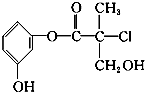

| A. | 该有机物的分子式为C10H11O4Cl | |
| B. | 该有机物与浓溴水可发生取代反应,且与浓硫酸混合共热可发生消去反应 | |
| C. | 1 mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH | |
| D. | 该有机物经催化氧化后与新制氢氧化铜悬浊液共热生成砖红色沉淀 |