题目内容
16.下列试剂存放方法错误的是( )| A. | 新制氯水--棕色瓶、阴凉处 | B. | 氢氟酸--橡皮塞、玻璃瓶 | ||
| C. | 少量金属钠--广口瓶、煤油里 | D. | 稀盐酸--细口瓶、阴凉处 |
分析 A.氯水中含有次氯酸,次氯酸见光易分解;
B.氢氟酸能够与二氧化硅反应;
C.钠是活泼的金属,易和水、氧气反应,钠的密度大于煤油的密度;
D.盐酸液体,易挥发.
解答 解:A.氯水中含有次氯酸,次氯酸见光易分解,应保存在棕色瓶,阴凉处,故A正确;
B.玻璃中含有二氧化硅,能够与氢氟酸反应,被氢氟酸腐蚀,所以氢氟酸保存在塑料瓶,故B错误;
C.钠是活泼的金属,易和水、氧气反应,钠的密度大于煤油的密度,应保存在广口瓶、煤油里,故C正确;
D.盐酸液体,易挥发,应保存在细口瓶、阴凉处,故D正确;
故选:B.
点评 本题主要考查了物质的保存方法,熟悉物质的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
1.锶(Sr)与镁是同主族元素.锶的单质及其化合物用途广泛,例如金属锶用于制造合金、光电管、照明灯,Sr(OH)2用于磨拉石的提纯,Sr(NO3)2用于烟火装置,SrCl2用于修补牙齿等.
(1)锶(Sr)位于周期表的第五周期,第ⅡA族,过氧化锶(SrO2)中锶元素的化合价为+2.
(2)金属锶在常温下和水反应,有气体生成,写出该反应的化学方程式Sr+2H2O=Sr(OH)2+H2↑
(3)金属锶很活泼,在空气中易被氧化,可保存在③中(填序号)
①水②酒精③煤油
(4)锶的性质与钙类似.已知:CaCl2易溶于水,CaF2难溶于水.请写出硝酸锶和氟化钠反应的离子方程式Sr2++2F-=SrF2↓.
(5)隔绝空气高温焙烧SrSO4和C粉的混合物,若2molSrSO4完全反应,只有S被还原并转移16mol电子,同时只生成一种可燃性气体.该反应的化学方程式:SrSO4+4C $\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑.
(6)在t℃时,某Sr(OH)2的稀溶液中c(H+)=10-amol•L-1 c(OH-)=10-bmol•L-1,已知a+b=12.向该溶液中逐滴加入pH=X的盐酸,测得混合溶液的部分pH如表所示.
若忽略溶液混合前后的体积变化,则X为4(用数字填空).
(1)锶(Sr)位于周期表的第五周期,第ⅡA族,过氧化锶(SrO2)中锶元素的化合价为+2.
(2)金属锶在常温下和水反应,有气体生成,写出该反应的化学方程式Sr+2H2O=Sr(OH)2+H2↑
(3)金属锶很活泼,在空气中易被氧化,可保存在③中(填序号)
①水②酒精③煤油
(4)锶的性质与钙类似.已知:CaCl2易溶于水,CaF2难溶于水.请写出硝酸锶和氟化钠反应的离子方程式Sr2++2F-=SrF2↓.
(5)隔绝空气高温焙烧SrSO4和C粉的混合物,若2molSrSO4完全反应,只有S被还原并转移16mol电子,同时只生成一种可燃性气体.该反应的化学方程式:SrSO4+4C $\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑.
(6)在t℃时,某Sr(OH)2的稀溶液中c(H+)=10-amol•L-1 c(OH-)=10-bmol•L-1,已知a+b=12.向该溶液中逐滴加入pH=X的盐酸,测得混合溶液的部分pH如表所示.
| 序号 | Sr(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | |||
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
8.活性炭可处理大气污染物NO.T℃时,在容积为2L的密闭容器中加入NO和一定量的炭粉在一定条件下发生如下可逆反应:C(s)+2NO(g)?CO2(g)+N2(g),测得各物质的物质的量如下表:
(1)一定温度下,在体积恒定的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是a、d(填字母序号).
a.单位时间内生成2mol NO,同时生成1mol N2
b.NO物质的量与CO2物质的量之比为2:1
c.容器中混合气体的压强不变
d.混合气体的密度不变
(2)0~2min内,用NO表示该反应的平均速率υ(NO)=0.1mol?L-1?min-1.
(3)已知升高温度,该可逆反应的化学平衡常数K增大,则该反应是吸热反应(填“吸热”或“放热”).T℃时,该反应的化学平衡常数K=9/16,则2min时正反应速率大于(填“大于”、“等于”或“小于”)逆反应速率.当该反应达到平衡时,NO的平衡转化率为60.0%.
(4)若其他条件不变,改变下列条件后,所得结论正确的是a、b(填字母序号).
a.恒压时,向容器中充入氦气,反应速率减小
b.升高温度,化学平衡正向移动
c.增大NO的浓度,NO的转化率增大
d.缩小容器的体积,平衡常数增大.
| 活性炭(mol) | NO(mol) | CO2(mol) | N2(mol) | |
| 起始状态 | 3.0 | 0.8 | 0 | 0 |
| 2min时 | 2.8 | 0.4 | 0.2 | 0.2 |
a.单位时间内生成2mol NO,同时生成1mol N2
b.NO物质的量与CO2物质的量之比为2:1
c.容器中混合气体的压强不变
d.混合气体的密度不变
(2)0~2min内,用NO表示该反应的平均速率υ(NO)=0.1mol?L-1?min-1.
(3)已知升高温度,该可逆反应的化学平衡常数K增大,则该反应是吸热反应(填“吸热”或“放热”).T℃时,该反应的化学平衡常数K=9/16,则2min时正反应速率大于(填“大于”、“等于”或“小于”)逆反应速率.当该反应达到平衡时,NO的平衡转化率为60.0%.
(4)若其他条件不变,改变下列条件后,所得结论正确的是a、b(填字母序号).
a.恒压时,向容器中充入氦气,反应速率减小
b.升高温度,化学平衡正向移动
c.增大NO的浓度,NO的转化率增大
d.缩小容器的体积,平衡常数增大.
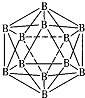 硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题:
硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题: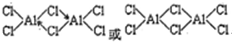 ;
;
 某混合物A,含有Al2(SO4)3、Al2O3、Fe2O3,在一定的条件下可实现如图所示的变化.请回答下列问题:
某混合物A,含有Al2(SO4)3、Al2O3、Fe2O3,在一定的条件下可实现如图所示的变化.请回答下列问题: