题目内容
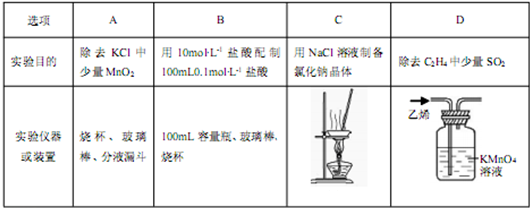
下列实验方案设计正确的是
| A.分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤 |
| B.失去标签的硝酸银溶液、稀盐酸、氢氧化钠溶液、氯化铝溶液,可以用碳酸铵溶液鉴别 |
| C.将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体 |
| D.检验从火星上带回来的红色物体是否是Fe2O3 的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
B
解析试题分析:A、分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质是二氧化锰,应该用热的浓盐酸洗涤,因为二氧化锰不能氧化稀盐酸,A不正确 ;B、硝酸银与碳酸铵溶液反应生成碳酸银白色沉淀,稀盐酸与碳酸铵溶液反应放出无色无味的气体CO2,氢氧化钠溶液与碳酸铵反应放出无色但具有刺激性气味的氨气,氯化铝与碳酸铵溶液生成白色沉淀氢氧化铝和CO2气体,因此可以鉴别,B正确;C、氯化铜溶液中铜离子水解,加热促进水解,且生成的氯化氢易挥发,因此最终得到的是氢氧化铜,得不到氯化铜晶体,需要在氯化氢的气流加热才能得到氯化铜晶体,C不正确;D、氧化铁不溶于水,因此向滤液中滴加KSCN溶液不能检验铁离子,应该用盐酸溶解,然后再滴加,D不正确,答案选B。
考点:考查实验方案设计与评价

练习册系列答案
相关题目
下列离子检验的方法正确的是
A.某溶液 有白色沉淀,说明原溶液中有Cl- 有白色沉淀,说明原溶液中有Cl- |
B.某溶液 有白色沉淀,说明原溶液中有SO42- 有白色沉淀,说明原溶液中有SO42- |
C.某溶液 有蓝色沉淀,说明原溶液中有Cu2+ 有蓝色沉淀,说明原溶液中有Cu2+ |
D.某溶液 生成无色气体,说明原溶液中有CO32- 生成无色气体,说明原溶液中有CO32- |
下列说法中正确的是( )
| A.分离Al2O3与Fe2O3混合物可以采取加入过量NaOH溶液充分反应后,过滤、洗涤、干燥 |
| B.用过量氨水除去Fe3+“溶液中的少量Al3+ |
| C.将Mg(OH)2放入表面皿中,加入足量盐酸,加热蒸干得无水MgCl2 |
| D.Al(OH)3中混有Mg(OH)2;加入足量烧碱溶液,充分反应过滤,向滤液中通入足量二氧化 |
选择合适的试剂(适量)对下列待提纯的物质进行除杂(括号内为杂质),
并写出相应的离子方程式。
| 待提纯的物质 | 选用的试剂 | 相应离子方程式 |
| (1) Mg (Al) | | |
| (2) FeCl3(FeCl2) | | |
现有三组溶液:①汽油和氯化钠溶液,②酒精和水的混合溶液,③氯化钠和单质溴的溶液,以上混合溶液分离的正确方法依次是
| A.分液、萃取、蒸馏 | B.萃取、蒸馏、分液 |
| C.分液、蒸馏、萃取 | D.蒸馏、萃取、分液 |
下列有关实验装置进行的相应实验,能达到实验目的的是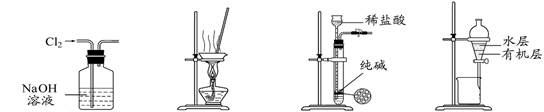
图1 图2 图3 图4
| A.用图1所示装置除去Cl2中含有的少量HCl |
| B.用图2所示装置蒸干FeCl3饱和溶液制备FeCl3晶体 |
| C.用图3所示装置制取少量纯净的CO2气体 |
| D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层 |