题目内容
【题目】氧化钴(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺流程如下:
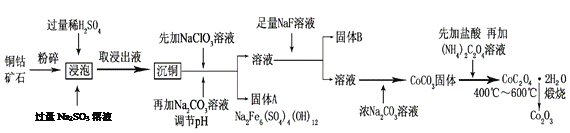
请回答下列问题:
(1)“浸泡”过程中,CoO(OH)可转化为CoSO4,请将该反应的化学方程式补充完整:
2CoO(OH)+2H2SO4+□_______=□CoSO4+□_______+□_______,_____________
(2)固体B的成分是______________________(填化学式)。
(3)向“沉铜”后的滤液中加入NaClO3溶液的主要目的是___________________;若上述流程中固、液分离均采用过滤操作,则共有________________处使用该操作。
(4)根据图1、图2分析:
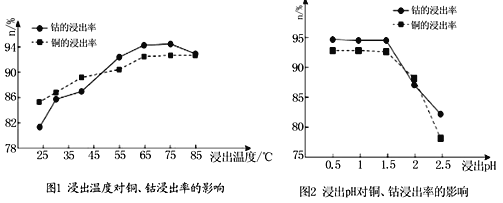
①矿石粉末浸泡的适宜条件应是________________________________。
②图2中铜、钴浸出率下降的可能原因是___________________________________。
(5)CoC2O4·2H2O在空气中高温煅烧得到Co2O3的化学方程式是_____________。
(6)LiCoO2可用于电动汽车的电池,其工作原理如右图所示,且电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为:LixC6+Li1-xCoO2 ![]() C6 +LiCoO2
C6 +LiCoO2
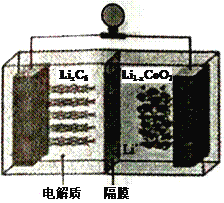
①放电时,Li+移动的方向为_________→___________。(填“ 左”或“ 右”)
②放电时正极的电极反应式为______________________________________。
【答案】 1 Na2SO3 2 1 Na2SO4 3 H2O CaF2、MgF2 将Fe2+氧化为Fe3+,再沉淀分离 6 温度:65℃~75℃、pH:0.5~1.5 pH升高后溶液中c(H+)浓度下降,使得溶解CoO(OH)、CoCO3、Cu2(OH)2CO3的能力下降 4 CoC2O4·2H2O+3O2![]() 2Co2O3+8CO2+8H2O 左 右 Li1-xCoO2+xLi++xe-= LiCoO2
2Co2O3+8CO2+8H2O 左 右 Li1-xCoO2+xLi++xe-= LiCoO2
【解析】(1)“浸泡”过程中,CoO(OH)可转化为CoSO4,根据流程图和氧化还原反应的规律,反应中Co的化合价降低,则亚硫酸钠中S的化合价升高,配平后的方程式为2CoO(OH)+2H2SO4+ Na2SO3=CoSO4+ Na2SO4+3H2O,故答案为:Na2SO3;Na2SO4;3H2O;
(2)某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等,根据(1)的分析,浸出液中含有CoSO4、Na2SO4,以及硫酸铜、硫酸镁、硫酸亚铁和少量硫酸钙,经过沉铜后加入氯酸钠将亚铁离子氧化,调节pH沉淀铁离子,得到的溶液中加入氟化钠主要生成氟化钙和氟化镁沉淀,故答案为:CaF2、MgF2;
(3)向“沉铜”后的滤液中加入NaClO3溶液的主要目的是将Fe2+氧化为Fe3+,再沉淀分离;若上述流程中固、液分离均采用过滤操作,则共有6处使用了过滤,分别为浸泡后取浸出液、沉铜、调节pH沉铁、加入氟化钠沉淀钙离子和镁离子、加入浓碳酸钠沉钴、碳酸钴用盐酸溶解后加入草酸铵生成草酸钴沉淀,故答案为:将Fe2+氧化为Fe3+,再沉淀分离;6;
(4)①根据图像,矿石粉末浸泡时的浸出率最高的条件为:温度在65℃-75℃、pH在0.5-1.5,故答案为:温度:65℃-75℃、pH:0.5-1.5;
②根据图像,pH升高后溶液中c(H+)浓度下降,使得溶解CoO(OH)、CoCO3、Cu2(OH)2CO3的能力下降,导致铜、钴浸出率下降,故答案为:pH升高后溶液中c(H+)浓度下降,使得溶解CoO(OH)、CoCO3、Cu2(OH)2CO3的能力下降;
(5)CoC2O4·2H2O在空气中高温煅烧得到Co2O3,钴元素的化合价升高,被空气中的氧气氧化,同时草酸根被氧化氧化生成二氧化碳和水,反应的化学方程式为4CoC2O4·2H2O+3O2![]() 2Co2O3+8CO2+8H2O,故答案为:4CoC2O4·2H2O+3O2
2Co2O3+8CO2+8H2O,故答案为:4CoC2O4·2H2O+3O2![]() 2Co2O3+8CO2+8H2O;
2Co2O3+8CO2+8H2O;
(6)根据电池反应式LixC6+Li1-xCoO2![]() C6 +LiCoO2知,负极反应式为LixC6-xe-=C6+xLi+、正极反应式为Li1-xCoO2+xLi++xe-=LiCoO2,充电时,阴极、阳极反应式与负极、正极反应式正好相反,所以左侧是负极、右侧是正极。
C6 +LiCoO2知,负极反应式为LixC6-xe-=C6+xLi+、正极反应式为Li1-xCoO2+xLi++xe-=LiCoO2,充电时,阴极、阳极反应式与负极、正极反应式正好相反,所以左侧是负极、右侧是正极。
①放电时,Li+由负极通过隔膜移向正极,即移动的方向为左→右,故答案为:左;右;
②放电时,正极反应式为Li1-xCoO2+xLi++xe-=LiCoO2,故答案为:Li1-xCoO2+xLi++xe-= LiCoO2。