题目内容
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果甲乙两组同学分别设计了如图一、图二所示的实验。
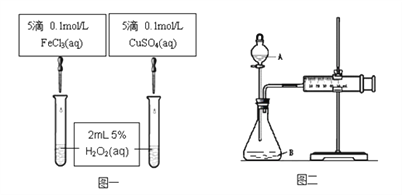
(1) 图一可通过观察____________________现象来定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是__________________,你认为还可以作其他何种改进? _____________________。
(2) 图二可用于定量比较反应的快慢,检查图二装置气密性的方法是________________。
利用图二做实验时需测量的数据是_____________________。
【答案】反应产生气泡快慢(或反应完成的先后或试管壁的冷热程度)控制阴离子相同,排除阴离子的干扰将FeCl3改为Fe2(SO4)3关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位,如回到原位证明气密性良好一定时间内收集到的气体体积或收集一定体积的气体所需要的时间
【解析】
试题分析:(1)产生气泡的快慢可以定性确定双氧水的分解速率大小,根据物质的微粒不同分析;
(2)根据乙图装置来选择气密性的检查方法;该反应是通过反应速率分析的,所以根据反应速率的表达式来判断.
解析:(1)可以通过观察产生气泡的快慢来定性比较比较Fe3+和Cu2+对H2O2分解的催化效果,将CuSO4改为CuCl2更为合理,这样Fe3+和Cu2+中的阴离子种类相同,可以排除因阴离子的不同可能带来的影响,还可以把氯化铁改为硫酸铁;
(2)结合乙图装置,该气密性的检查方法为:关闭分液漏斗活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位;反应是通过反应速率分析的,根据v=△V/△t,实验中需要测量的数据收集一定体积的气体所需要的时间或一定时间内收集的气体体积。





