��Ŀ����
����Ŀ����ѧ�С����������װ�ã��Ʊ�LiH���塣
��1��Ԫ��������ڱ��е�λ�� __________________��
��2����LiH�����бȽ����Ӱ뾶��С��ϵr(Li+) _________r(H-)��(����>������<��)
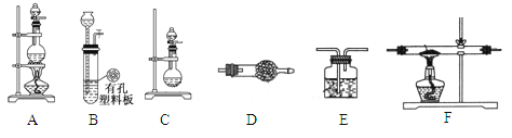
��3���С����������������װ���Ʊ�LiH���塣��ѡ�õ�ҩƷ�У�����ﮡ�п����ϡ���ᡢŨ���ᡢ��ʯ�ҡ���֪���⻯ﮣ�LiH���ڸ���Ŀ��������ȶ����ڣ���ˮ�����ܹ�����ȼ�ա����ʵ�鷽�����£�
������װ������˳��ΪB��D��F��E������ҩƷǰ����Ҫ���е�ʵ�������___________________������д������IJ���������������ҩƷ������װ��D��������____________________________��
��ͨ��һ��ʱ�����������ʯӢ�ܣ��ڼ���F����ʯӢ��֮ǰ��������е�ʵ�������_______________________________��
�ۼ���һ��ʱ���ֹͣ���ȣ�����ͨ������ȴ��Ȼ��ȡ��LiH��װ�뵪���ƿ������ڰ�������ȡ����������Ŀ����Ϊ�˱���LiH������е�ˮ�����Ӵ�������Σ�ա����LiH��ˮ��Ӧ�Ļ�ѧ����ʽ___________________________________��
��ȷ�����ƵõIJ�Ʒ0.11g����һ��������������ˮ��Ӧ���ռ�������291.2 mL���ѻ���ɱ�״���������Ʒ��LiH��Li�����ʵ���֮��Ϊ____________��
���𰸡� �ڶ�����IA�� < ����װ�õ������� ��ȥH2�е�H2O��HCl �ռ�E���ų������岢����H2���� LiH + H2O = LiOH + H2�� 6��1
����������1��Ԫ��﮵�ԭ��������3�������ڱ��е�λ���ǵڶ�����IA������2����������Ų���ͬʱ���Ӱ뾶��ԭ���������������С�������Ӱ뾶��С��ϵr(Li+)��r(H-)����3�����Ʊ�����װ�ã�����ҩƷǰ����Ҫ���е�ʵ������Ǽ���װ�õ������ԣ����ɵ������к���ˮ�������Ȼ��⣬��Ҫ��ȥ����װ��D�м�ʯ�ҵ������dz�ȥH2�е�H2O��HCl���������ǿ�ȼ�����壬����ڼ���F����ʯӢ��֮ǰ��������е�ʵ��������ռ�E���ų������岢����H2��������LiH��ˮ��Ӧ����������﮺���������Ӧ�Ļ�ѧ����ʽΪLiH+H2O��LiOH+H2��������LiH��Li�����ʵ����ֱ�Ϊxmol��ymol����
LiH+H2O=H2��+LiOH
xmol xmol
2Li+2H2O=2LiOH+H2��
ymol 0.5y mol
��8x+7y��0.11��22.4(x+0.5y)��0.2912�����x=0.012��y=0.002����LiH��Li�����ʵ���֮��Ϊ0.012mol��0.002mol=6��1��

 �Űٷֿ�ʱ����ϵ�д�
�Űٷֿ�ʱ����ϵ�д� ������״Ԫ��ҵϵ�д�
������״Ԫ��ҵϵ�д�