题目内容
下列说法正确的是
| A.常温下,pH = 7的氨水与氯化铵的混合溶液中:c(Cl-) = c(NH4+) |
| B.常温下pH = 5的盐酸溶液稀释1000倍后pH = 8 |
| C.在BaSO4的饱和溶液中加入一定量Na2SO4固体,BaSO4的溶解度和Ksp均变小 |
| D.0.1 mol·L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) |
AD
解析试题分析:氨水与氯化铵的混合溶液中存在的四种离子是NH4+、H+、OH-、Cl-,根据电中性可得:c(H+)+c(NH4+)=c(Cl-)+c(OH-),混合溶液pH=7说明c(H+)=c(OH-),则c(NH4+)=c(Cl-),故A正确;盐酸显酸性,无论怎样稀释,稀释后溶液仍显酸性,pH只能无限地接近7,不可能大于等于7,故B错误;加入硫酸钠固体,增大硫酸根离子浓度,使BaSO4(s)  Ba2++SO42-的平衡向逆反应方向移动,析出沉淀导致硫酸钡的溶解度减小,说明硫酸钡在水中的溶解度比在硫酸钠溶液中的溶解度大,但是Ksp只与温度有关,温度不变溶度积不变,故C错误;硫酸铵是强电解质,则(NH4)2SO4=2NH4++SO42-,不考虑水解时,铵根离子的浓度是硫酸根离子浓度的2倍,硫酸根离子不能水解,少部分铵根离子水解,导致溶液呈弱酸性,大部分铵根离子不水解,则溶液中铵根浓度介于硫酸根离子浓度的1~2倍之间,所以稀硫酸铵溶液中c(NH4+)>c(SO42-)>c(H+)>c(OH-),故D正确。
Ba2++SO42-的平衡向逆反应方向移动,析出沉淀导致硫酸钡的溶解度减小,说明硫酸钡在水中的溶解度比在硫酸钠溶液中的溶解度大,但是Ksp只与温度有关,温度不变溶度积不变,故C错误;硫酸铵是强电解质,则(NH4)2SO4=2NH4++SO42-,不考虑水解时,铵根离子的浓度是硫酸根离子浓度的2倍,硫酸根离子不能水解,少部分铵根离子水解,导致溶液呈弱酸性,大部分铵根离子不水解,则溶液中铵根浓度介于硫酸根离子浓度的1~2倍之间,所以稀硫酸铵溶液中c(NH4+)>c(SO42-)>c(H+)>c(OH-),故D正确。
考点:考查溶液的pH和离子浓度大小关系,涉及电荷守恒原理、强酸无限稀释前后的pH、沉淀溶解平衡的移动与溶度积的关系、弱电解质、强电解质、盐类水解等。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案常温下,用Na2SO3溶液吸收SO2时,溶液pH随n(SO32-):n(HSO3-)变化的关系如下表:
| n(SO32-):n(HSO3-) | 91:1 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
以下离子浓度关系的判断正确的是
A.NaHSO3溶液中c(H+)<c(OH-)
B.Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)=c(H+)
D.当吸收液呈中性时,c(Na+)= c(HSO3-)+2 c(SO32-)
己知H2CO3的酸性强于H2S,将amol·L -1 NaHS与bmol·L-1NaOH两种稀溶液等体积混合(a>0,b>0),所得溶液中微粒间的物质的量浓度关系正确的是
| A.a=b时:c(OH-)= c(H+)+c(HS-) |
| B.a=2b时:c(S2-)>c(HS )>c(OH-)>c(H+) |
| C.a=3b时:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| D.a=4b时:4c(Na+)=5c(S2-)+5c(HS-)5c(H2S) |
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是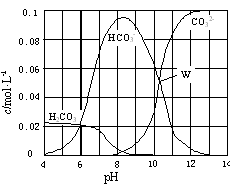
| A.W点所示的溶液中:c(Na+)+ c(H+)=2c(CO32-)+ c(OH-)+ c(Cl-) |
| B.pH=4的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)<0.1 mol·L-1 |
| C.pH=8的溶液中:c(H+)+ c(H2CO3)+ c(HCO3-) = c(OH-)+c(Cl-) |
| D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3) |
现有常温下的四份溶液:①0.01 mol/L CH3COOH;②0.01 mol/L HCl;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是
| A.①中水的电离程度最小,③中水的电离程度最大 |
| B.将②、③混合,若有pH=7,则消耗溶液的体积:②>③ |
| C.将①、④混合,若有c(CH3COO-)>c(H+),则混合液一定呈碱性 |
| D.将四份溶液分别稀释100倍后,溶液的pH:③>④,①>② |
常温下,将V1mL c1mol/L的醋酸滴加到V2mL c2mol/L的氢氧化钠溶液中,下列结论正确的是
| A.若将c1mol/L的醋酸冲稀10倍,则其pH增大1 |
| B.若将c2 mol/L的氢氧化钠溶液冲稀10倍,则其pH减小1 |
| C.若c1? V1=c2?V2,则混合液中c(CH3COO-)=c(Na+) |
| D.若混合液的pH=7,则混合液中c(CH3COO-)=c(Na+) |
常温下,有关醋酸溶液的叙述中错误的是
| A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COOˉ) |
| B.将pH=3的醋酸稀释为pH=4的过程中,c(CH3COOH)/ c(H+)比值不变 |
| C.浓度均为0.1mol/L的CH3COOH与CH3COONa溶液等体积混合后:c(CH3COOˉ)+ c(CH3COOH)="2" c(Na+) |
| D.amLpH=3的醋酸溶液与bmLpH=11的NaOH溶液恰好完全中和时,a=b |
对于常温下pH=3的乙酸溶液,下列说法正确的是( )
| A.c(H+)=c(CH3COO-) + c(OH-) |
| B.加水稀释到原体积的10倍后溶液pH变为4 |
| C.加入少量乙酸钠固体,溶液pH降低 |
| D.与等体积pH为11的NaOH溶液混合后所得溶液中:c(Na+)=c(CH3COO-) |
含SO2的烟气会形成酸雨,工业上常利用Na2SO3溶液作为吸收液脱除烟气中的SO2。随着SO2的吸收,吸收液的pH不断变化。下列粒子浓度关系一定正确的是:
A.Na2SO3溶液中存在: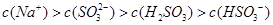 |
B.已知NaHSO3溶液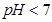 ,该溶液中: ,该溶液中: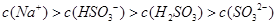 |
C.当吸收液呈中性时: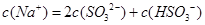 |
D.当吸收液呈酸性时: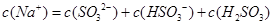 |