题目内容
【题目】I.二甲醚是一种重要的清洁燃料.合成二甲醚是解决能源危机的研究方向之一.
(1)用CO2和H2可以合成二甲醚(CH3OCH3)
已知:CO(g)+2H2(g)═CH3OH(g)△H1=﹣90.1kJ/mol
CO(g)+H2O(g)═CO2(g)+H2(g)△H2=﹣41.1kJ/mol
2CH3OH(g)═CH3OCH3(g)+H2O(g)△H3=﹣24.5kJ/mol
则反应2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=____________.
(2)二甲醚(CH3OCH3)燃料电池可以提升能量利用率.利用二甲醚酸性介质燃料电池电解200mL饱和食盐水(惰性电极),电解一段时间后,阴极收集到标况下的氢气2.24L(设电解后溶液体积不变)
①二甲醚燃料电池的正极反应式为_____________________________.
②请写出电解食盐水的化学方程式____________________.
③电解后溶液的pH=_________.
II.室温下,0.1 mol·L-l的KOH溶液滴10.00mL 0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
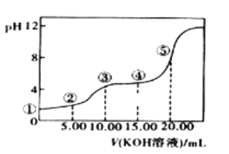
(3)点③所示溶液中所有离子的浓度由大到小的顺序为:___________________。点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O422-)=________mol/L。
【答案】﹣122.5 kJ·mol﹣1 O2+4e﹣+4H+=2H2O 2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑ 14 c(K+)>c(HC2O4―)>c(H+)>c(C2O42-)>c(OH―) 0.10
2NaOH+Cl2↑+H2↑ 14 c(K+)>c(HC2O4―)>c(H+)>c(C2O42-)>c(OH―) 0.10
【解析】
I.(1)利用盖斯定律计算所需热化学方程式;
(2))①原电池负极发生氧化反应,二甲醚在负极放电,酸性条件下生成二氧化碳碳,正极是氧气得到电子在酸性溶液中生成水,结合电荷守恒和原子守恒书写电极反应;
②电极饱和食盐水生成氢氧化钠、氯气和氢气;
③根据电解氯化钠溶液的电解方程式来求溶液的pH,结合电极反应和电子守恒计算消耗二甲醚的质量.
II.(3)点③时两溶液恰好完全反应生成了KHC2O4,溶液显酸性,HC2O4-的电离程度大于水解程度;
(4)结合物料守恒进行分析;
:(1)利用盖斯定律进行计算,将三个方程式进行形式变换,
①CO(g)+2H2(g)═CH3OH(g)△H1=-90.1kJ/mol
②CO(g)+H2O(g)═CO2(g)+H2(g)△H2=-41.1kJ/mol
③2CH3OH(g)═CH3OCH3(g)+H2O(g)△H3=-24.5kJ/mol
盖斯定律计算①×2-2×②+③得到:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)△H=-122.5 kJmol-1,故答案:-122.5 kJmol-1;
(2))①正极上是氧气得到电子发生还原反应,在酸性溶液中生成生成水,故答案为:O2+4e-+4H+=2H2O;
②电极饱和食盐水阳极氯离子失电子发生氧化反应生成氯气,阴极氢离子得到电子发生还原反应生成氢气,同时溶液中生成氢氧化钠,故答案为:![]() ;
;
③生成的氢气为2.24L(标况)即为0.1mol,根据点解方程式可知此过程中生成氢氧根0.2mol,忽略溶液的体积变化,则c(OH-)=0.2mol/200mL=1mol/L,故pH值为14,故答案为:14;
II.(3)点③时两溶液恰好完全反应生成了KHC2O4,溶液显酸性,HC2O4-的电离程度大于水解程度,则溶液中离子浓度关系为:c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(4)点④所示的溶液的体积25mL,根据物料守恒:c(HC2O4-)+c(H2C2O4)+c(C2O42-)=0.10mol/L×![]() =0.04mol/L;c(K+)=0.10mol/L×
=0.04mol/L;c(K+)=0.10mol/L×![]() =0.06mol/L,所以c(HC2O4-)+c(H2C2O4)+c(C2O42-)+c(K+)=0.10molL-1,故答案为:0.10;
=0.06mol/L,所以c(HC2O4-)+c(H2C2O4)+c(C2O42-)+c(K+)=0.10molL-1,故答案为:0.10;

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案